
Vol. 38, n.º 2, 2005
REVISTA
ESPAÑOLA DE
Vol. 38, n.º 2, 2005 |
REVISIONES
Marcial García Rojo, Gloria Bueno García1, Jesús González García, Manuel Carbajo Vicente
Servicio de Anatomía Patológica. Complejo Hospitalario de Ciudad
Real.
1 ETS Ingenieros Industriales. Universidad de Castilla-La
Mancha. Ciudad Real.
marcial@cim.es
RESUMEN
La digitalización total de preparaciones microscópicas de citologías, biopsias y autopsias es una realidad hoy día, gracias a los avances en los sistemas informáticos. Esta evolución hacia la imagen digital conlleva la necesidad de disponer de conocimientos básicos de esta nueva forma de gestionar la imagen médica. Estos conocimientos permiten al patólogo comprender mejor el funcionamiento de los llamados sistemas de microscopía virtual. En este artículo se revisan los aspectos de imagen digital relacionados con la calidad de las preparaciones virtuales o digitales, como la dimensión en píxeles, resolución espacial, tamaño de ficheros, sistema de compresión, formatos de fichero y rango dinámico. Se concluye que el uso eficaz de la microscopía digital tendrá importantes beneficios en los servicios de Anatomía Patológica.
Palabras clave: microscopía virtual, imagen digital, preparaciones digitales.
SUMMARY
The development of complete slide digitization systems in Pathology has become possible thanks to recent advances in computing systems. The efficient use of these digital slide systems can be achieved with a basic knowledge of digital imaging. This article reviews the main concepts related to quality in Pathology virtual slide images, such as image size in pixels, spatial resolution, file size, compression methods, file formats, and dynamic range. It is concluded that the efficient use of digital microscopy can offer important benefits to Pathology departments.
Key words: virtual microscopy, digital imaging, digital slides.
INTRODUCCIÓN
Los sistemas de imagen digital en Anatomía Patológica no sólo deben contemplar soluciones para la imagen microscópica, sino que deben contemplar toda la imaginología necesaria para el desempeño eficaz del trabajo del patólogo, es decir, la imagen macroscópica (biopsias y piezas quirúrgicas e, incluso, citologías), p. ej. fotografías o vídeos del estudio macroscópico de algunas piezas; imagen microscópica (biopsias, bloques celulares, citologías, autopsias), tanto de las tinciones habituales como técnicas especiales (inmunofluorescencia, inmunohistoquímica); y patología molecular (FISH, CISH, geles y matrices de tejidos).
La tecnología disponible hoy día nos permite ir evolucionando hacia una digitalización completa de toda la imagen, si bien lo habitual es incluir sólo algunos casos considerados interesantes o que son consultados en sesiones clínico-patológicas. En pocos años, los inconvenientes técnicos existentes serán solventados y todos los casos estudiados por los servicios de Anatomía Patológica podrán ser completamente digitalizados.
La digitalización total de la imagen con la que trabaja el patólogo, incluidas las preparaciones, permite ayudarle a trabajar de forma más eficiente en un entorno informatizado, ya que facilita el uso de los sistemas de información al no tener que recurrir a diversos formatos (analógicos y digitales).
En este trabajo se revisan los términos habitualmente empleados en el contexto de la imagen digital médica, sobre todo los relativos a la digitalización de preparaciones histológicas y citológicas.
En una segunda parte, se revisarán los aspectos técnicos específicos de los sistemas de microscopía virtual existentes en el mercado, que facilite encontrar el sistema más adecuado a cada objetivo (análisis de imagen automatizado, cuantificación en inmunohistoquímica, archivo de preparaciones, teleconsulta, e-learning, etc.). También se realiza un estudio sobre el futuro impacto de la microscopía virtual en los servicios de Anatomía Patológica.
CONCEPTOS BÁSICOS EN MICROSCOPÍA DIGITAL
Microscopía virtual o microscopía digital
Habitualmente, se utiliza el término microscopía virtual para definir la captura y el almacenamiento de la imagen digital microscópica de un área amplia o de toda la preparación histológica o citológica y no sólo de uno o varios campos representativos, con el fin de poder disponer de todas las zonas representativas de una preparación y poder trabajar con la pantalla del ordenador u otro dispositivo informático en vez de utilizar un microscopio (1,2) (fig. 1).

Fig. 1: Sistema
de microscopía virtual Olympus-SIS .slide.
Microscopía digital es un concepto genérico que incluye todos los aspectos o componentes relacionados con esta nueva forma de trabajar:
La captura o adquisición de imágenes (creación de preparación digital).
Archivo de preparaciones (en formato digital).
Visualización de preparaciones (en la pantalla del ordenador).
Transmisión y compartimiento de toda la preparación.
El término microscopía virtual no nos parece muy acertado, ya que el concepto «virtual» frecuentemente se utiliza en oposición a efectivo o real. Sin embargo, la digitalización del proceso no supone que la imagen sea menos real que la obtenida directamente mediante el sistema óptico del microscopio. El término «imagen virtual», tal y como lo define el Diccionario de la Real Academia Española, aplicado a óptica, tampoco nos parece aplicable a la microscopía totalmente digitalizada y no recoge la idea de disponer de una copia (digital) de toda la preparación. Con la microscopía digital podemos simular el funcionamiento de un microscopio convencional, pero seguimos disponiendo de la laminilla original, a la que se podrán aplicar otras tinciones, estudios de ADN, análisis multiespectral, etc.
Por todo ello, nos parece más adecuado utilizar el término microscopía digital, aunque utilizaremos ambos términos (virtual y digital) en el mismo sentido.
La tabla 1 recoge los sistemas de microscopía digital existentes en el mercado.

Preparaciones virtuales (virtual slides) o preparación digital
Una preparación virtual (o digital) es la imagen digital que se crea tras digitalizar completamente una preparación. Un sistema de microscopía digital permite crear preparaciones digitales.
Las preparaciones digitales deben ser consideradas una copia digital de la preparación convencional y nunca sustituirán a éstas, por lo expuesto en el apartado anterior; sin embargo, disponer de una copia digital pueden repercutir significativamente en la gestión de las preparaciones actuales (tiempo de conservación, archivo,…) (3).
La preparación digital podría ser considerada como una imagen o fotografía digital de gran tamaño, y se crean, generalmente a partir de un escaneado a gran aumento de la preparación, pero dadas sus dimensiones especiales, requiere sistemas informáticos especiales, como ordenadores con procesadores avanzados, o programas de visualización específicos para cada tipo de preparación virtual, según el fabricante.
Estas soluciones especiales aún no se han estandarizado, y cada fabricante dispone de soluciones distintas para crear preparaciones digitales, no intercambiables entre sí.
Fotografía digital
Tanto la captura de un solo campo microscópico como la fotografía macroscópica suelen ser realizadas con cámaras fotográficas digitales. La imagen generada es una fotografía digital, que consisten en ficheros en formatos estándares de imagen (JPEG o TIFF, generalmente).
La tabla 2 resume las diferencias entre una imagen o fotografía digital y una preparación digital, aplicadas a microscopía.

Vídeo digital
La imagen en movimiento también puede ser capturada mediante cámaras de vídeo digital. Este tipo de imagen puede ser utilizada en Patología para la grabación de sesiones de macroscopía o de autopsias.
Algunos patólogos reclaman también la digitalización completa en el estudio macroscópico y no sólo en el estudio microscópico. El llamado estudio macroscópico virtual (virtual gross pathology) podría permitirnos establecer una correlación exacta entre los hallazgos macroscópicos y el estudio microscópico, identificando de dónde se toma cada muestra de tejido, sin lugar a errores. Actualmente el término «estudio macroscópico virtual» sólo se utiliza para el contexto de endoscopia virtual en radiología (4).
Telepatología
La telepatología es definida como la visualización e interpretación remota de especímenes.
La telepatología se suele clasificar en estática, también llamada de «almacenar y enviar», (por ejemplo, el envío por correo electrónico de fotografías de un solo campo de una preparación) o dinámica (un ejemplo sería la transmisión en directo de una señal de vídeo desde un microscopio.
Con la microscopía virtual o digital también es posible realizar telepatología, es decir, enviar las preparaciones a distancia, pero no es la única aplicación de la microscopía digital, ya que también permite por ejemplo, el análisis de imagen automatizado para la ayuda al diagnóstico o cuantificación inmunohistoquímica automatizada, que, pueden realizarse en la mesa del patólogo, sin necesidad de transmitir las imágenes de esas muestras a distancia.
La microscopía virtual o digital facilita el uso de la telepatología. En este caso, la información que contiene toda la preparación digital, que puede consistir en varios gigabytes de información, no precisa ser transmitida en su totalidad al otro lado de la red de comunicaciones, pues pueden usarse visualizadores que permiten sesiones de telepatología basadas en microscopía virtual, en las que el programa recoge del servidor de preparaciones digitales, sólo los trozos de las mismas que son solicitadas por el usuario.
CALIDAD DE LA PREPARACIÓN DIGITAL
La preparación virtual como toda imagen digital está formada por un número finito de pequeños elementos llamados píxeles (picture-element) dispuestos en una estructura rectangular.
Por lo tanto, los criterios de calidad de la imagen microscópica digital son igualmente aplicables:
Dimensiones de la imagen.
La resolución espacial (píxeles/área).
Profundidad o resolución de intensidad (número de colores).
Rango dinámico (histograma, niveles de grises).
Fidelidad en la reproducción de color (ruido).
La fidelidad en la reproducción de color depende del dispositivo de visualización, por ejemplo, la calidad del monitor empleado para ver la preparación digital, por lo que será explicada en el siguiente artículo.
Dimensiones de la imagen en píxeles
Puesto que la imagen digital es una estructura rectangular, el tamaño viene definido por el número de píxeles en longitud o dimensión horizontal (H) multiplicado por el número de píxeles en anchura o dimensión vertical (V) (fig. 2).
![]()
Fig. 2: Cálculo
de las dimensiones de una imagen digital.
Las preparaciones digitales se capturan con objetivos 20´ ó 40´. Para un área de tejido en el porta de 15 mm ´ 15 mm se calcula que las dimensiones de una preparación digital sería de 30.000 ´ 30.000 píxeles (900 millones de píxeles o Mpíxeles) si se captura mediante un objetivo 20´, o de 60.000 píxeles ´ 60.000 píxeles (3.600 Mpíxeles) sin se captura con un objetivo 40´.
Resolución espacial o muestreo espacial
La separación entre cada píxel o el tamaño real de cada píxel de una imagen digital depende, fundamentalmente del dispositivo de captura.
La resolución espacial se mide en puntos (o píxeles) por pulgada (ppp), también llamado «dots per inch» (dpi) o en micrómetros por píxel.
De esta forma, podemos comprobar que dos imágenes con las mismas dimensiones en píxeles (800 ´ 600), pero con distinta resolución espacial, una de 96 ppp y otra de 600 ppp, se verán de forma distinta según el medio empleado para visualizarlas.
Si la imagen de 96 ppp es visualizada en una pantalla de ordenador, la calidad percibida puede ser la misma que la de 600 ppp, pues la pantalla del ordenador tiene una resolución máxima de 96 ppp. Sin embargo, si ambas imágenes se imprimen con el mismo tamaño, la imagen de 96 ppp será impresa con peor calidad que la de 600 ppp (fig. 3). Esto es así, porque las impresoras necesitan mayores resoluciones (menos espacio entre píxeles) que la pantalla del ordenador, a veces de hasta 2.400 ppp.

Fig. 3: La
resolución espacial debe adaptarse al dispositivo final para el que será
utilizada la imagen digital.
La resolución espacial debe contemplar las dos dimensiones (vertical y horizontal) de la imagen digital y por ello se expresa como 96 ppp ´ 96 ppp, pero cuando ambas valores son idénticos, a menudo se utiliza sólo un valor (96 ppp) para referirse a ambos.
Recordemos que 1 pulgada = 25,4 mm = 25.400 micras y que 1 mm = 0,03937 pulgadas.
Si se utiliza un objetivo 20´ para adquirir imágenes digitales, según su apaertura numérica (NA), obtendremos, generalmente, una resolución de 0,46 micrómetros por píxel (véase fig. 4). Es decir, cualquier estructura que midiese menos de 0,46 micras no podría ser visualizada. Como la medida estándar de resolución no es el micrómetro por píxel, sino el punto o píxel por pulgada (ppp), realizamos las operaciones matemáticas oportunas:
0,46 micras/píxel En 1 micra obtendremos 2,17 píxeles.
En 1 mm de longitud obtendremos 2.173,91 píxeles.
En 1 pulgada obtendremos 55.217,5 píxeles en cada dimensión.
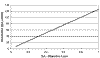
Fig. 4: Equivalencia
entre la apertura numérica de un microscopio óptico y la resolución espacial
necesaria en una imagen digital para obtener la misma calidad.
Por lo tanto, la digitalización real de una preparación, con un objetivo ´20, se realiza a 55.217,5 píxeles por pulgada (ppp).
Si se utiliza un objetivo 40´, la resolución es de 0,23 micrómetros por píxel, es decir, el doble que con el objetivo 20´, por lo que obtendríamos una resolución espacial de 110.435 ppp.
Un negativo fotográfico convencional de 35 mm, que mide 24 ´ 36 mm, si fuese escaneado con la máxima resolución que ofrece el grano de la película, es decir, a 1 micrómetro/píxel, resultaría una imagen de 24.000 ´ 36.000 píxeles (864 Mbytes).
Dado que no existen dispositivos informáticos de visualización o impresión que alcancen esa resolución espacial de las preparaciones digitales (50.000 o 100.000 ppp), las imágenes microscópicas digitales que no requieran un procesado, normalmente se guardan con una resolución final de 96 ppp a 300 ppp.
Una preparación digital creada con una resolución de 50.000 píxeles por pulgada contiene el mismo nivel de detalle que un microscopio que utilice un objetivo con una lente de 0,4 de apertura numérica (NA). La figura 4 refleja esta equivalencia.
Se denomina paradoja piramidal de la imagen a la siguiente observación: cuanto mayor es el aumento de una lente y mayor es la resolución de la imagen digitalizada, menor es el área de la preparación que consigue representar la imagen digitalizada. Por el contrario, cuanto mayor sea el campo seleccionado utilizando un objetivo de menor aumento, peor es la resolución de la imagen capturada, por lo que la imagen se aprecia con peor calidad (fig. 5) (5).

Fig. 5: Paradoja
piramidal de las imágenes Modificado de (5).
Profundidad o resolución de intensidad
Cada píxel contiene una cantidad de información variable, relacionada con el color. Si queremos representar todo el espectro de colores básicos, necesitamos que para cada píxel se almacenen 8 bits por cada color básico (rojo, azul y verde), es decir, cada píxel ha de almacenar 24 bits de información sobre color. Dado que 8 bits = 1 byte, la información de color se almacena utilizando 3 bytes.
TAMAÑO DEL FICHERO
Es necesario evitar confundir las dimensiones (en píxeles) de la imagen con el tamaño (en bytes) del fichero en el que la imagen se almacena.
Para calcular el tamaño final de una imagen hay que contemplar los siguientes factores ya explicados:
La dimensión de la imagen (número total de píxeles).
La resolución espacial o separación entre píxeles.
Profundidad de color o resolución de intensidad (número de colores).
Posible compresión aplicada a la imagen.
Dimensiones
Para un área de tejido de 15 ´ 15 mm, con el objetivo 40´, capaz de discriminar 0,23 micrómetros por píxel, el número píxeles que obtendríamos sería:
(Dimensión horizontal/resolución)
´ (Dimensión
vertical/resolución) = (15 ´
1000 micras/0,23) ´
(15 ´ 1000 micras/0,23) =
(15 ´ 1000 micras/0,23) ´
(15 ´ 1000 micras/0,23) =
65.200 ´ 65.200 píxeles
Resolución espacial y visualización
Una imagen de 65.200 ´ 65.200 píxeles es tan grande que sólo es posible visualizarla por partes en el monitor del ordenador (que tiene una resolución habitual de 96 ppp), que podrá mostrarnos, por ejemplo, trozos de 1024 ´ 768 píxeles. Puesto que el patólogo precisa recorrer múltiples campos con el microscopio convencional, es necesario incorporar un sistema de rastreo de las preparaciones digitales para poder examinarlas en su totalidad a grandes aumentos.
Profundidad de color o resolución de intensidad (información de color)
El último factor que nos permite calcular el tamaño de una imagen sin comprimir es la profundidad de color. Por lo tanto, la fórmula para calcular el tamaño final, en bytes, de una imagen sin comprimir es la siguiente:
(Dimensión horizontal/resolución) ´ (Dimensión vertical/resolución) ´ 3 (en bytes)
Puesto que en el ejemplo de una preparación de 15 ´ 15 mm, digitalizada con un objetivo 40´, se obtienen unas dimensiones de 65.200 píxeles ´ 65.200 píxeles (4.251 Mpíxeles), el tamaño de la imagen final se obtiene al multiplicar los 4.251 Mpíxeles por la información de color de cada píxel (´ 3), es decir, 12,7 gigabytes (GB).
Si quisiéramos digitalizar toda la superficie ocupada por el cubreobjetos (50 mm ´ 25 mm), necesitaríamos generar un fichero de unos 80 GB sin comprimir, por cada preparación.
Múltiples planos en el eje Z
Estos cálculos se refieren a la digitalización de un único plano en el eje Z. Es posible crear preparaciones digitales que recogen múltiples planos, que permiten recoger toda la información que tienen las preparaciones histológicas muy gruesas y, sobre todo, las preparaciones citológicas que no son monocapa. Esto permite simular en la pantalla del ordenador el movimiento del micrométrico en el microscopio. Para que esto sea posible, la cantidad de información generada se multiplica tantas veces como número de planos de digitalización sean recogidos en la preparación digital.
Compresión
La compresión es una técnica de proceso de imagen que permite reducir significativamente el tamaño de los ficheros de imágenes.
Las técnicas de compresión se clasifican en «técnicas con pérdida» y «técnicas sin pérdida», según se pierdan datos o la imagen permanezca exactamente tal y como fue adquirida. Las técnicas de compresión sin pérdida sólo pueden reducir la cantidad de información a la mitad o a la tercera parte. Sin embargo, dado que el tamaño de los ficheros generados por las preparaciones virtuales es muy grande, es necesario emplear técnicas con pérdida, que permiten obtener ficheros de imágenes 10 a 50 veces más pequeños que el original. A continuación, describimos los principales métodos de compresión con pérdida utilizados en microscopía digital.
El método de compresión más utilizado es JPEG (Joint Photographic Experts Group), que comprime imágenes en bloques de 8 píxeles ´ 8 píxeles.
En general, se ha observado que la imagen microscópica puede ser comprimida mediante JPEG hasta un 60% permitiendo mantener una calidad máxima. Con este algoritmo de compresión las imágenes macroscópicas pueden ser comprimidas aún más (75%) para un grado similar de calidad.
JPEG2000 utiliza un formato de compresión más eficiente que JPEG, basado en transformadas ondiculares wavelets, que utiliza bloques mucho mayores de tamaño configurable. Permite comprimir más las imágenes y mantener una mayor calidad de las mismas.
Las imágenes digitales almacenan en cada píxel información sobre color. Normalmente se asignan 8 bits (1 byte) para cada canal de color RGB (rojo, verde, azul), en total, 24 bits. Estos 24 bits permiten que a cada píxel pueda asignársele valores entre 0 y 255. Los algoritmos de compresión se aprovechan de la falta de percepción por el ojo humano de diferencias inferiores a 5 en la información de color (de 0 a 255) de cada píxel, sobre todo si los píxeles adyacentes tienen diferencias inferiores. También se sabe que el ojo humano es especialmente sensible a las diferencias en el canal verde y menos a la información de rojo o azul, lo que se aprovecha en las técnicas de compresión (6).
La tabla 3 compara la eficiencia de compresión de JPEG y JPEG2000.

En general, JPEG2000 consigue aproximadamente el doble de compresión para el mismo nivel de calidad, pero supone prácticamente el doble de tiempo de computación. Por ello, algunas soluciones incorporan aceleradores hardware de la compresión JPEG2000.
Las figuras 6 a 9 muestran algunos ejemplos escaneados con el sistema Aperio Scanscope.

Fig. 6: Esta
imagen H-E incluye un alto porcentaje de áreas sin tejido, vacías, por lo que
será más comprimible que otras preparaciones con más tejido. Este área de 18.052
x 21.433 píxeles requeriría 1,1GB (6).

Fig. 7: El
tejido teñido con tricrómico de Masson contiene muchas zonas teñidas de azul. El
color azul es más comprimible que otros colores. Además, esta preparación tiene
áreas densas rojo oscuras, por lo que hay algunos gradientes de color. Este
ejemplo tiene un tamaño de 71.961 x 37.470 píxeles, lo que supone 7,7GB de
información (6).

Fig. 8: Esta
imagen H-E está tomada de un tejido muy denso. Este tipo de imágenes es menos
comprimible que otras. El ejemplo representa un área de 57.841 x 39.240 píxeles,
lo que supone 6,4GB de datos (6).

Fig. 9: La
imagen histológica contiene muchas áreas de contraste de luz. Estas áreas son
muy sensibles a artefacto en las compresiones con pérdidas. El ejemplo
representa un área de 55.848 x 35.307 píxeles y ocupaba 5,6 GB (6).
Formatos de fichero
Aunque a menudo se confunden, es necesario recordar que el tipo de compresión es distinto al tipo de fichero con el que se guarda el fichero de imagen en el disco duro. El tipo de fichero (tabla 4) es la organización interna del fichero o formato del contenedor que contiene toda la información sobre la imagen. Los ficheros comprimidos con JPEG se guardan en el disco duro con un formato llamado JFIF (Jpeg File Interchange Format), pero en el lenguaje coloquial a esos ficheros los llamamos JPEG porque los ficheros JFIF/JPEG generalmente se usan con la extensión «.jpg» o «.jpeg».

El tamaño máximo de un fichero que un ordenador convencional es capaz de manipular es de 4 GB. Dado que un fichero JPEG comprimido permite comprimir de forma eficaz 15 veces o más, la información real almacenada en un fichero de 4 GB podría superar los 60 GB. Si la información se comprime con JPEG2000, la información real de un fichero de 4 GB podría superar los 100 GB, una cantidad de datos muy superior a la que puede manejar un ordenador.
Los ficheros JP2 a menudo son denominados «ficheros JPEG2000».
El formato TIFF (Tagged Image Format File), a diferencia de JPEG no implica el uso de un algoritmo de compresión determinado, sino que puede contener imágenes sin comprimir («raw») o imágenes comprimidas con técnicas sin pérdida (como LZW) o con pérdida (JPEG o JPEG2000).
El formato GIF (Graphics Interchange Format) no es útil para almacenar imágenes microscópicas porque sólo permite almacenar 8 bits de información de color (256 niveles de colores).
Dado que los formatos JP2 (JPEG2000) y JFIF (JPEG) tienen una organización interna en tiras, para visualizar una zona determinada del fichero, es necesario recoger todas las tiras completas que engloban era región. Por otra parte, cuando un fichero JPEG se recibe incompleto, con su cabecera correcta, se aprecia cómo se interrumpe la imagen en una línea determinada (figura 10).

Fig. 10: Fichero
JFIF/JPEG recibido incompleto, en el que se aprecia la interrupción de la última
línea recibida.
A diferencia de los ficheros JFIF/JPEG y JP2/ JPEG2000, los ficheros con formato TIFF pueden tener una estructura interna en cuadrados o rectángulos y no en tiras, por lo que la cantidad de información que es necesario recuperar para visualizar sólo una parte de la preparación es mucho menor. Por ello, este es el formato de ficheros utilizado por algunos fabricantes de microscopía virtual.
Rango dinámico (histograma o niveles de grises) para mejorar el contraste
Las tonalidades para cada color básico (rojo, verde y azul) se representan mediante niveles de grises (entre 0 y 255) para cada punto. Por ejemplo, píxel determinado es rojo si muestra un valor de 255 para rojo y 0 para verde y azul, o es amarillo si muestra un valor 255 para rojo y para verde y 0 para el azul.
Es posible calcular qué rango de niveles de grises para cada color existe en una imagen utilizando una herramienta llamada «histograma» o «ecualizador de niveles». Gracias a ella, podemos comprobar que el principal defecto de las imágenes demasiado oscuras o poco contrastadas es tener un rango dinámico muy estrecho (por ejemplo, entre 59 y 176), es decir, el rango de valores del histograma está poco distribuido. Si se amplía el rango entre 25 a 250, se consigue aumentar el contraste de la imagen microscópica (figs. 11a y b). Este ajuste puede hacerse aún más preciso, ajustando los valores de forma individual para cada color básico.
![]()
Fig. 11: A)
Imagen de una neoplasia de paratiroides, con un
histograma de grises de 59 a 176 en la imagen original. B) La misma
imagen al ampliar el rango de valores de gris (25 a 250).
CONCLUSIONES
El objetivo primordial del uso de la microscopía virtual o de las preparaciones digitales en los servicios de Anatomía Patológica debe ser ayudar al patólogo en su labor asistencial (7). Una vez conseguido esto, podemos explotar otras ventajas del sistema, como integrar la imagen de Patología con el resto de la historia clínica electrónica.
Las ventajas que pueden derivarse de compartir la imagen de patología en forma de preparaciones virtuales, son la mejor formación de los estudiantes y médicos residentes, que tendrán una idea más aproximada del trabajo realizado por el patólogo, a la vez que las anotaciones y áreas seleccionadas les permiten centrarse rápidamente en los aspectos morfológicos de interés de cada preparación, sin perder la información de contexto.
Además de los aspectos docentes, existen muchas otras aplicaciones de las preparaciones digitales, de gran importancia hoy día, como la teleconsulta o telepatología en general, el control de calidad y la mejora en la gestión asistencial.
Por todo ello, consideramos esencial disponer de conocimientos básicos sobre imagen digital, que permitirán comprender los importantes recursos tecnológicos que conlleva el uso de la imagen totalmente digitalizada en Patología y que supera con creces los necesarios para la imagen radiológica.
De hecho, la microscopía digital, aunque dispone de diversas soluciones comerciales, algunas de uso relativamente sencillo, aún tiene algunos retos tecnológicos que debe superar de forma más eficiente, que podemos resumir en dos: la gran cantidad de información que es precisa almacenar para obtener preparaciones de calidad diagnóstica, y el tiempo tan prolongado que exige la digitalización completa a gran aumento de las preparaciones. Es previsible que en el plazo de cinco años todas estas limitaciones tecnológicas sean superadas y la digitalización sea un proceso más al que someteremos todas las preparaciones microscópicas de biopsias, citologías y autopsias.
AGRADECIMIENTOS
Este trabajo ha sido realizado gracias las ayudas a la investigación, proyecto número DPI2004-01346 del Ministerio de Educación y Ciencia y fondos FEDER, y a la beca número EQ04002 de la Consejería de Sanidad de la Junta de Comunidades de Castilla-La Mancha.
BIBLIOGRAFÍA
Ferreira R, Moon B, Humphries J, Sussman A, Saltz J, Miller R, Demarzo A. The Virtual Microscope. Proc AMIA Annu Fall Symp. 1997; 449-53. Disponible en: http://citeseer.ist.psu.edu/ferreira97virtual.html.
Alfaro Ferreres L, García Rojo M, Puras Gil AM. Manual de Telepatología. Pamplona: SEAP. 2001. Disponible en: http://www.seap.es/telepatologia/.
Costello SP, Johnston DJ, Dervan PA, O’ Shea DG. Development and Evaluation of the Virtual Pathology Slide: A New Tool in Telepathology. Journal of Medical Internet Research 2003;5(2):e11. Disponible en: http://www.jmir.org/2003/2/e11/.
Chaoui AS, Blake MA, Barish MA, Fenlon HM. Virtual colonoscopy and colorectal cancer screening. Abdom Imaging 2000; 25:361-7. Disponible en: http://www.radiology.org.yu/download/vcolon.
3D Histech. Theory of digital slide production. 2002. Disponible en: http://www.3dhistech.com/article.php?chap=1&sub=4.
Aperio Technologies, Inc. Aperio Compression performance measurements. 22-feb-2005. Disponible en: http://www.aperio.com/documents/.
Nicholson JH. Histology and Digital Imaging – Present and Future Technologies. Histologic 2001; 34: 27-32.