
Vol. 42, n.º 4, 2009
REVISTA
ESPAÑOLA DE
Vol. 42, n.º 4, 2009 |
ORIGINALES
Francisco José Gómez García1, Vicente Vicente Ortega2, Nuria Álvarez Sánchez2, Pía López Jornet1
1 Departamento de
Dermatología, Estomatología, Radiología y Medicina Física. Universidad de
Murcia. E-mail: fjgomez@um.es.
2 Cátedra de Anatomía Patológica, Instituto Universitario de
Investigación en Envejecimiento de la Universidad de Murcia.
RESUMEN
Introducción: El carcinoma oral de células escamosas es una neoplasia maligna con mal pronóstico y baja tasa de supervivencia, en cuya etiología están fuertemente implicados el tabaco y el alcohol, entre otros factores. En 1954, Salley describió un modelo experimental de carcinogénesis en la mucosa yugal del hámster mediante la aplicación del agente DMBA. Métodos: Hemos desarrollado dos modelos experimentales diferenciados, basados en la aplicación del DMBA sobre cobayas y hámster respectivamente. Resultados: En el primer modelo (cobayas) no ocurrió el fenómeno de la carcinogénesis con el tiempo y las dosis administradas. Solamente observamos áreas de displasia epitelial, que era más severa en los animales que, además del tratamiento con DMBA, ingerían etanol. En el segundo modelo (hámster), se desarrollaron neoplasias malignas, que eran más numerosas y con un comportamiento biológico más agresivo cuando se administraba el DMBA combinado con el etanol. Conclusiones: El etanol se ha comportado como agente promotor de la carcinogénesis.
Palabras clave: Carcinogénesis oral, modelo experimental, DMBA, hámster, cobayas.
SUMMARY
Introduction: Oral squamous cell carcinoma is a malignant neoplasm with a bad prognosis and low survival rate. Tobacco and alcohol are among the most important causative factors. In 1954, Salley described an experimental model of carcinogenesis, applying the agent DMBA to the jugal mucosa of hamsters. Methods: we have developed two different experimental models based on the application of DMBA to guinea pigs and hamsters. Results: No carcinogenesis was seen in the guinea pigs at the administered doses of DMBA, only areas of epithelial dysplasia, which were more severe in the animals that were also given alcohol. Malignant neoplasias developed in the hamsters and were more numerous and more aggressive when DMBA was administered together with ethanol. Conclusions: In the present study, ethanol acted as an enhancer of carcinogenesis.
Keywords: Oral carcinogenesis, experimental model, DMBA, hamster, guinea pig.
INTRODUCCIÓN
El carcinoma oral de células escamosas es una neoplasia maligna caracterizada por un mal pronóstico y una baja tasa de supervivencia. A pesar de los grandes avances en biología celular y molecular, oncología y cirugía, la tasa de morbilidad y mortalidad de esta enfermedad permanece invariable desde hace años (1). Los factores de riesgo más importantes del cáncer oral siguen siendo el tabaco y el alcohol (2), aunque también han sido fuertemente implicados en su etiología virus como el del papiloma humano y la predisposición genética del individuo (3).
Desde que los agentes químicos se describieron como principales factores etiológicos del cáncer oral, se han desarrollado diversos modelos animales con el objetivo de estudiar los mecanismos de la carcinogénesis. Uno de los más conocidos es el modelo descrito por Salley en 1954 (4), en el que tras la aplicación del carcinógeno químico 7,12-dimetil-1,2-benzantraceno (DMBA) en la mucosa yugal del hámster, se desarrollan carcinomas de células escamosas y lesiones premalignas muy similares a las humanas.
Nuestra hipótesis de trabajo consistió en el desarrollo de un modelo experimental de carcinogénesis oral en roedores (cobayas y hámster) mediante la aplicación tópica del hidrocarburo aromático policíclico (DMBA) y la ingestión de etanol, con el fin de estudiar de modo sistematizado las lesiones desarrolladas.
MATERIAL Y MÉTODOS
Hemos realizado dos modelos experimentales diferenciados utilizando cobayas y hámster respectivamente.
ANIMALES
Para el modelo I hemos utilizado 50 cobayas tricolor (Cavia porcellus) con un peso medio de 365,6 g y una media de edad de 4 meses al inicio de los experimentos; y para el desarrollo del segundo modelo fueron empleados 28 hámster sirios (Mesocricetus auratus) cuyo peso medio al comienzo de los experimentos fue de 114,22 g y la media de edad de 5 meses. Todos los animales procedían del servicio de animales de laboratorio del SAI (Servicios de Apoyo a la Investigación), licencia n.º REGAES 300305440012 de la Universidad de Murcia, donde se mantuvieron en cajas de 22 x 22 cm (484 cm2). En el caso de los cobayas, cada caja contenía un animal mientras que los hámster se distribuían en grupos de cinco o seis animales, y eran provistos de comida y bebida «ad libitum». Todos los animales fueron mantenidos y utilizados siguiendo las normas de la UE para la protección de animales utilizados en experimentación (86/609/CEE).
AGENTES
Modelo I
Hidrocarburo policíclico aromático 7,12-dimetil-1,2-benzantraceno (DMBA), obtenido de Sigma Aldrich Co. El DMBA se disolvía en acetona (Sigma Aldrich Co, Madrid, España) al 0,5%.
12-O-tetradecanoilforbol-13-acetato (TPA), obtenido de Sigma Aldrich Co. La dilución se realizaba en acetona al 0,2%.
Etanol absoluto disuelto en agua al 1,2% Obtenido de Guinama (Valencia, España).
Modelo II
DMBA al 0,5% disuelto en acetona.
Etanol absoluto al 1,2% en el agua de bebida.
PROCEDIMIENTO EXPERIMENTAL
Modelo I
Los animales del primer experimento se distribuyeron, de forma aleatoria, en los siguientes grupos experimentales y control:
Grupos control
Grupo I: Acetona (n=10).
Grupo II: Etanol al 1,2% en el agua de bebida (n=10).
Grupos tratados
Grupo III: DMBA (n=10)
Grupo IV: DMBA + TPA (n=10)
Grupo V: DMBA + TPA + Etanol (n=10)
Los animales de los grupos I, III, IV y V eran sedados tres veces a la semana para la aplicación de los agentes en el borde postero-lateral izquierdo de la lengua de forma tópica. Previamente se realizaba la erosión del epitelio con pincel de pelo de camello del número 4 con el fin de favorecer la penetración de los agentes. El DMBA se administraba en dosis de 2 µg disueltos en 80 µl de acetona, mientras que la dosis de TPA era de 2,5 µg que se aplicaban disueltos en 0,2 ml de acetona.
En el grupo III, los animales recibieron el tratamiento con DMBA durante 40 semanas, mientras que los de los grupos IV y V se trataron 20 semanas con DMBA y las 20 restantes con TPA. Además, los animales del grupo V ingerían alcohol en el agua de bebida al 1,2% durante todo el experimento. Así, la dosis total de DMBA y TPA administrada a cada uno de los animales fue de 240 µg de DMBA para los animales del grupo III y de 120 µg de DMBA más 150 µg de TPA a los animales de los grupos IV y V.
En cuanto al etanol, sabiendo que un cobaya adulto bebe diariamente unos 10 ml de agua, podemos estimar el consumo total al final de los experimentos en 33.6 ml de etanol absoluto.
Modelo II
Los animales del segundo modelo se distribuyeron en tres grupos de forma aleatoria:
Grupos control
Grupo I: Etanol al 1,2% en el agua de bebida (n=12).
Grupos tratados
Grupo II: DMBA al 0,5% en acetona (n=8).
Grupo III: DMBA al 0,5% en acetona + Etanol al 1,2% en el agua de bebida (n=8).
El método de aplicación de los agentes en los grupos II y III era similar al utilizado con los animales del modelo I, salvo que en este caso se administraban en la mucosa yugal izquierda y no se realizaba erosión previa. La cantidad de carcinógeno aplicada era de 1 µg. Como el período experimental fue de 11 semanas, la dosis total de carcinógeno con la que se trató a cada animal fue de 33 µg.
Tanto los animales del modelo I como los del modelo dos, se pesaban semanalmente y se observaban con detenimiento la lengua y la mucosa yugal izquierda en cobayas y hámster respectivamente, así como tejidos adyacentes a la pincelación en busca de cambios tisulares macroscópicos como el eritema, ulceraciones, leucoplasia o tumefacciones.
Además, siguiendo el procedimiento utilizado por Feng, 2006 (5), registramos el tiempo en semanas en el que el 50% de los animales de cada grupo había desarrollado tumores (T50). El tamaño de dichos tumores se medía en milímetros en 3 direcciones ortogonales (A, B y C) y calculábamos su volumen mediante la fórmula: V = ABC (n/6).
A las 40 semanas en el caso de los cobayas y a las 11 semanas en el de los hámster, se procedió al protocolo de eutanasia mediante cámara de CO2 con todos los animales y se extirparon las mucosas tratadas y las vísceras. Las muestras tisulares fueron fijadas en formol neutro tamponado al 10%, al menos durante 48 horas, para ser incluidas en parafina, seccionadas a 4 µm de espesor y teñidas con Hematoxilina y Eosina por el método habitual seguido en la Cátedra de Anatomía Patológica. Facultad de Medicina y Odontología de la Universidad de Murcia. En un caso del grupo III del modelo II, se realizó el estudio inmunohistoquímico según la metodología del servicio de Anatomía Patológica del Hospital General Universitario Reina Sofía de Murcia, utilizando los anticuerpos: CD68, AE1/AE-, P-S100, CD3, CD4, CD5, CD8 y vimentina.
El estudio morfológico de todas las muestras tisulares se realizó con microscopía óptica. Las preparaciones fueron estudiadas por dos observadores, que dependiendo del grado de lesión se valoraron de una a tres cruces (+,++,+++) los siguientes parámetros morfológicos:
1. Epitelio: Hiperqueratosis, paraqueratosis, ortoqueratosis, acantosis, papilomatosis, hiperplasia de células basales, displasia de grado I, displasia de grado II, displasia de grado III.
2. Corion o lámina propia: Respuesta mesenquimal (fibroplasia laminar vertical, proliferación vasos capilares e infiltrado inflamatorio).
3. Neoplasias: Carcinoma «in situ», carcinoma predominantemente exofítico, carcinoma invasor, otros.
MÉTODO ESTADÍSTICO
Hemos realizado una estadística descriptiva de cada variable observada, obteniendo las distribuciones de frecuencias. En los casos de variables cuantitativas, se calcularon parámetros característicos: media, desviación típica, máximo y mínimo. La comparación de grupos se hizo mediante análisis de varianza de una vía, complementado con contrastes de igualdad de pares de medias, con el método de la mínima diferencia significativa y con la corrección de Bonferroni (confirmando previamente que se cumplían las condiciones aplicables de Anova).
RESULTADOS
Modelo I
Macroscópicamente, los animales de los grupos tratados III, IV y V y del grupo control I presentaban leve eritema a partir de la tercera semana de tratamiento. Posteriormente, estas zonas rojizas adquirían una coloración blanquecina adoptando morfología macroscópica similar a la de la leucoplasia oral humana, salvo porque eran lesiones de tipo predominantemente macular y no en placa (fig. 1).
Microscópicamente, observamos hiperqueratosis, que era más intensa en los grupos tratados con el DMBA (III, IV y V) que en los controles (I y II) con diferencias estadísticamente significativas (p=0,005). Esta hiperqueratinización del epitelio se producía de forma normal (ortoqueratosis) con más frecuencia en los animales de los grupos controles que en los tratados, en los que predominaba la paraqueratosis.
La acantosis y la hiperplasia de células basales eran menos intensas en el grupo control II (etanol) que en los restantes grupos con diferencias estadísticamente significativas. En el grupo I eran más intensas que en el II pero menos que en los grupos III, IV y V con diferencias estadísticamente significativas. Entre los grupos III, IV y V no existía significatividad estadística respecto a estas dos variables.
En cuanto a la respuesta mesenquimal, también era más intensa en los grupos tratados que en los controles con diferencias estadísticamente significativas excepto entre los grupos II (control etanol) y III (DMBA).
Ninguno de los animales de los grupos I y II (controles) desarrolló displasia. De los grupos tratados, la displasia era más severa en los animales del grupo V (fig. 2), con diferencias estadísticamente significativas con respecto a los del grupo III, pero no con los del IV. En este último, el grado de displasia también era más intenso que en el grupo III, con diferencias estadísticamente significativas. El fenómeno de la carcinogénesis no ocurrió en ninguno de los grupos tratados ni controles, no observándose ninguna lesión macroscópica ni microscópica que sugiriera la presencia de una neoplasia maligna.
Modelo II
Grupo I (etanol al 1,2% en el agua de bebida)
Macroscópicamente no observamos cambios en el epitelio oral de los animales de este grupo. La mucosa yugal aparecía sonrosada y plegada sobre sí misma de la forma habitual.
Microscópicamente, existía cierto grado de hiperqueratosis en todas las muestras observadas, que era menor que en los grupos II y III con diferencias estadísticamente significativas y en la que predominaba la ortoqueratosis sobre la paraqueratosis.
La acantosis, papilomatosis, hiperplasia de céIuIas basales y la respuesta conectiva eran de menor intensidad que en los grupos II y III con diferencias estadísticamente significativas. Ningún animal de este grupo presentó displasia epitelial ni carcinoma.
Grupo II (aplicación tópica de DMBA)
En las primeras 8 semanas de tratamiento no observamos cambios macroscópicos relevantes en la mucosa de los animales tratados. A partir de ese tiempo y en adelante, comenzaron a desarrollarse, en tres de los animales, lesiones exofíticas de coloración variable que podían ser pediculadas y con aspecto papilomatoso o bien tener una inserción más amplia en la mucosa. Normalmente, surgía una única lesión pero a los pocos días aparecían más lesiones similares en zonas adyacentes (fig. 3).
Morfológicamente, todas las lesiones incipientes eran muy parecidas, salvo por la coloración, que variaba mucho de unas a otras. Había algunas lesiones de color rojo intenso que denotaban un gran componente vascular; así como otras de color marrón parduzco e incluso otras blancas debido a la marcada queratinización.
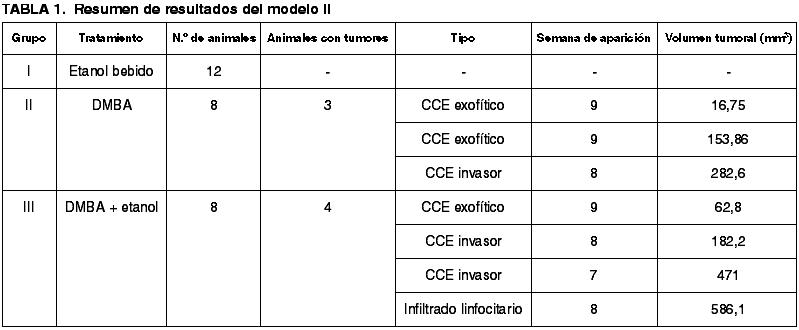
El tamaño de los tumores fue siempre en aumento desde su origen en las semanas octava y novena, hasta el final de los experimentos (semana undécima), donde se observó una diferencia de tamaño que iba desde los 16,75 mm3 del tumor más pequeño a los 282,6 mm3 del mayor.
Tres de los animales de este grupo desarrollaron tumores macroscópicos (50%), con un T50 de 9 semanas.
Microscópicamente, observamos todo el espectro de la carcinogénesis. Dependiendo de la zona del epitelio oral observada, existía displasia de grados I, II ó III, carcinoma «in situ», carcinoma exofítico o carcinoma invasor.
La hiperqueratosis era muy marcada en los animales de este grupo y superior a la de los animales del grupo I con diferencias estadísticamente significativas. El tipo de queratinización predominante era la paraqueratosis, con diferencias estadísticamente significativas con respecto al grupo I aunque no con el III.
En todos los animales se observaron áreas de acantosis, papilomatosis e hiperplasia de células basales (con diferencias estadísticamente significativas respecto al grupo control). La respuesta conectiva no era relevante.
Las zonas displásicas se caracterizaban por engrosamiento epitelial, debido a la proliferación de las células de los estratos inferiores. No observamos diferencias estadísticamente significativas con respecto al grupo III.
En tres animales se desarrollaron carcinomas de células escamosas que estaban constituidos por nidos o cordones irregulares de queratinocitos poligonales o globulosos, que presentaban moderado pleomorfismo. Dos de ellos presentaban un crecimiento predominantemente exofítico con microinvasión y sólo uno de ellos crecía además, infiltrando el corion subyacente en profundidad. Los citoplasmas de las células neoplásicas eran usualmente amplios y eosinófilos. Los núcleos eran hipercromáticos, vesiculosos, con nucléolos únicos o múltiples, voluminosos y eosinófilos, así como con ocasionales figuras de mitosis. Asimismo, era frecuente la observación de fenómenos de disqueratosis y la formación de globos córneos.
Grupo III
En este grupo, el comienzo de las lesiones orales tuvo lugar una semana antes que en el grupo del DMBA individualizado (semana 7) y el tiempo en que la mitad de los animales habían desarrollado algún tumor (T50) fue de 8 semanas.
Macroscópicamente no observamos diferencias relevantes entre las lesiones de este grupo con respecto a las del anterior en su comienzo. Se trataba de lesiones nodulares, exofíticas y pediculadas de aspecto papilomatoso.
Sin embargo, sí observamos mayor agresividad biológica y velocidad de crecimiento de los tumores de este grupo. Algunos de ellos alcanzaron un gran volumen final y presentaban una superficie ulcerada con sangrado espontáneo. El volumen de los tumores al final del experimento variaba entre los 62,7 mm3 del tumor más pequeño a los 586,1 mm3 del más grande (fig. 4).
Microscópicamente, la hiperqueratosis era intensa y similar a la de los animales del grupo II, con diferencias estadísticamente significativas con respecto al grupo I y con predominio de la paraqueratosis sobre la ortoqueratosis. La acantosis, papilomatosis, hiperplasia de células basales y la respuesta conectiva no eran cuantificables debido a la alta prevalencia de carcinomas.
Observamos múltiples áreas de displasia de diferente grado en todos los animales y en cuatro de ellos, neoplasias malignas.
Sin embargo, la tipología de los tumores así como el patrón de crecimiento de los mismos era diferente al de los animales en los que se aplicó el DMBA solamente. En este caso, los tumores desarrollados por tres de los animales fueron carcinomas de células escamosas. En uno de ellos, presentaban un crecimiento exofítico con microinvasión de tejidos subyacentes mientras que en los otros dos crecían en profundidad adhiriéndose a planos subyacentes y a los tejidos de la vecindad (fig. 5). La lesión desarrollada por otro de los animales no pudimos diagnosticarla con la tinción de Hematoxilina y Eosina, por lo que se realizó un estudio inmunohistoquímico de esta lesión. La vimentina, anticuerpos de citoqueratinas AE1/AE, CD68 y CD8 fueron negativos, y la proteína S100 y anticuerpos CD3, CD4 y CD5 positivos (fig. 6) (tabla 1).
DISCUSIÓN
Desde la descripción del mecanismo de la carcinogénesis en dos fases: iniciación y promoción, han sido numerosos los agentes que se han ensayado, de forma experimental, con el objetivo de conocer lo más fielmente posible el mecanismo de producción de la carcinogénesis oral en humanos. Entre ellos, destacan el alquitrán de carbón, el 20-metil-colantreno, el 4NQO (6,7), el polioxietileno-sorbitan-monosterato (Tween 60) (8) o el aceite de crotón (9), que han sido ampliamente utilizados en el desarrollo de modelos animales de carcinogénesis oral (10). No obstante, el modelo experimental citado con mayor frecuencia en la bibliografía científica corresponde al descrito por Salley en 1954 (4) y que fue estandarizado posteriormente por Morris en 1961 (11). Este modelo consistía en la aplicación tres veces a la semana de una solución del carcinógeno químico 7,12-dimetil-1,2-benzantraceno (DMBA) al 0,5% en la mucosa yugal del hámster sirio.
Probablemente, la enorme difusión del modelo radica en la gran similitud que presentan las lesiones desarrolladas con las del cáncer oral en humanos, ya que para muchos autores, los tumores desarrollados son morfológica e histológicamente muy similares al carcinoma oral de células escamosas y además, expresan también muchos de los marcadores bioquímicos y moleculares del cáncer oral en humanos (12).
Cuando nos planteamos el desarrollo de un modelo de carcinogénesis en la cavidad oral, elegimos la lengua del cobaya tricolor, debido a que la lengua corresponde a la localización más frecuente del cáncer oral en humanos (13). El motivo por el que elegimos este animal fue la experiencia de nuestro grupo de investigación en estudios previos, así como su cavidad oral relativamente grande, lo que facilita la aplicación de los agentes, y su comportamiento dócil.
Por otra parte, Renstrup en 1962 (14), demostró que la irritación crónica, al estimular la proliferación celular, favorece la acción de los carcinógenos orales y aumenta el riesgo de desarrollar cáncer. En este sentido, Perez, 2005 (15) desarrolló un modelo animal en el que combinaba la aplicación de DMBA con la presencia de úlceras provocadas que no dejaba cicatrizar y concluyó que la úlcera traumática crónica, por sí misma no incrementa el riesgo de transformación maligna, pero actuaba como un agente promotor, lo que permitía reducir en más de la mitad las dosis de DMBA necesarias para originar los tumores. Por este motivo, cuando nos planteamos el primer modelo experimental, decidimos aplicar el DMBA después de erosionar la mucosa lingual de los cobayas, con el fin de favorecer la penetración del agente carcinógeno.
La fuerte relación existente entre el alcohol, el tabaco y el cáncer oral ha sido descrita ampliamente tanto en estudios clínicos como epidemiológicos y experimentales. El alcohol puede actuar de varias formas; puede ser un co-carcinógeno al combinar su efecto con el de otros agentes carcinógenos; por otra parte, al metabolizarse, su derivado acetaldehído tiene efecto carcinogénico propio y al asociarse a ciertos carcinógenos como el tabaco, puede originar sinergismo o sin-carcinogénesis, potenciando el efecto del tabaco hasta dieciseis veces (16). Por lo que, con el objeto de estudiar el efecto del etanol en la carcinogénesis oral experimental inducida por DMBA, incluimos en nuestro modelo experimental un grupo en el que tratamos a los animales, además de con la aplicación del carcinógeno, con etanol al 1,2% en el agua de bebida.
En cuanto a la concentración del agente carcinógeno utilizada, elegimos la dosis de 2 µg de DMBA por animal aplicada tres veces a la semana y los tiempos de tratamiento, similares a los que nuestro grupo de trabajo utilizó previamente en el desarrollo de un modelo de carcinogénesis cutánea en cobayas albinos (17,18). En este modelo, realizado sobre 60 cobayas albinos, se desarrollaron miles de lesiones hiperplásicas, displásicas y neoplásicas, tanto epiteliales (4.415) como melanocíticas (1.114) (19).
Respecto al tiempo medio de presentación de los tumores descrito en la bibliografía en la mucosa yugal del hámster, que varía de 8 a 12 semanas según los autores, en los cobayas de nuestro estudio no se originó ninguna tumoración macroscópica que nos sugiriera la presencia de neoplasia maligna. Por este motivo, decidimos continuar con la aplicación de los agentes durante el mismo período de tiempo que empleamos previamente en el modelo de carcinogénesis cutánea en cobayas antes citado. De este modo, mantuvimos a uno de los grupos con el tratamiento trisemanal con DMBA durante 40 semanas (cuatro veces superior a las dosis utilizadas en los modelos sobre hámster) y decidimos aplicar el promotor tumoral TPA en dos de los grupos experimentales. Ambos grupos habían sido tratados durante 20 semanas, el primero con DMBA de forma individualizada y el segundo con DMBA y etanol en el agua de bebida, y les aplicamos, además el TPA durante 20 semanas más.
Una vez finalizado el experimento, al no haber conseguido la presentación de carcinomas de células escamosas en la mucosa lingual de los cobayas, nos planteamos las posibles causas de no haber conseguido desarrollar la carcinogénesis epitelial, que creemos, por una parte puede deberse a que la concentración del carcinógeno, así como la duración del tratamiento, no fueran suficientes para el desarrollo de neoplasias malignas en la mucosa oral del cobaya; o bien, la resistencia de la mucosa lingual del cobaya a los efectos carcinogénicos del DMBA o incluso a que el carcinógeno fuese deglutido y no actuase, por tanto, durante el tiempo necesario. Ante estos resultados, nos volvimos a plantear el desarrollo de un nuevo modelo de carcinogénesis oral, pero tomando como referencia un modelo experimental similar descrito en la bibliografía con el hámster como animal.
En este segundo modelo, nuestro objetivo fundamental consistió en intentar lograr el desarrollo de carcinomas de células escamosas en los hámster, para conocer sus características morfológicas y biológicas así como poder estudiar el efecto del etanol como agente promotor. En este sentido, diversos autores han estudiado el efecto del etanol en la carcinogénesis inducida por DMBA en hámster (20,21). En todos los casos, los animales que eran tratados con los dos agentes de forma simultánea, desarrollaban tumores en un período menor que los tratados con DMBA de forma individualizada.
En el modelo original, en el que se aplicaba el DMBA disuelto en aceite mineral, los tumores se originaban lentamente en un período superior a las 12 semanas, comenzando con queratosis y lesiones displásicas similares a la leucoplasia oral (22-24). Las lesiones precancerosas (displasia) se desarrollaban a las 8-10 semanas; entre las 12 y las 14 semanas se observaban carcinomas «in situ» y a las 18-20 semanas carcinomas invasores. Sin embargo, estos tiempos se acortaban a 9-10 semanas cuando el DMBA era disuelto en alcohol (20) o a 10-12 semanas cuando se incorporaba el alcohol en el agua de bebida (21).
En nuestro estudio, el grupo de animales del modelo II (hámster) que fueron pincelados con DMBA y simultáneamente tratados con alcohol en el agua de bebida, comenzaron a desarrollar tumores en la séptima semana, un período menor que el descrito en la bibliografía consultada. Estos tumores experimentaron un rápido crecimiento que obligó a sacrificar a los animales en la undécima semana debido al gran volumen tumoral desarrollado, que impedía su alimentación. Es decir, en nuestro modelo se acortaba el período de latencia tumoral respecto a los trabajos antes citados.
Los animales a los que no aplicamos el etanol junto con el DMBA (grupo II) comenzaron a desarrollar tumores una semana después que los que recibían el tratamiento combinado. Pero quizá, la diferencia más relevante entre estos dos grupos fue que los tumores mostraban una progresión más rápida y un comportamiento biológico más agresivo cuando se administraban los dos agentes (grupo III).
Aunque está demostrado que el etanol, además de actuar como agente promotor de la carcinogénesis, posee efecto carcinógeno propio, en nuestro trabajo no provocó el desarrollo de neoplasias malignas al aplicarlo de forma individualizada. Así, en los animales en los que administramos el etanol de forma individualizada (grupo control I), no observamos ningún cambio macroscópico relevante en el epitelio oral a lo largo del experimento, aunque microscópicamente existía cierto grado de hiperqueratosis con predominio de la ortoqueratosis sobre la paraqueratosis. En ningún animal de este grupo observamos displasia epitelial ni carcinomas.
Por otra parte, según la bibliografía consultada, la administración combinada del etanol con el agente carcinógeno DMBA, además del acortamiento del período de latencia tumoral, hace que los tumores alcancen volúmenes mayores, sean más invasivos e histológicamente menos diferenciados que cuando se aplica el DMBA de forma individualizada (20,25,26).
En nuestro estudio, los resultados obtenidos en el grupo III (DMBA + Etanol) coinciden con lo descrito en la bibliografía, ya que en este grupo se observó mayor incidencia tumoral que en el grupo en el que aplicamos el DMBA solamente. Observamos cuatro animales con tumores, frente a los tres animales que desarrollaron neoplasias en el grupo II.
Los tumores desarrollados en los animales del grupo del DMBA más etanol, también diferían de los desarrollados en el resto de los grupos por los volúmenes que alcanzaban, el modo de crecimiento y el tipo histológico.
De los cuatro animales que desarrollaron neoplasias malignas en este grupo, en tres casos fueron carcinomas de células escamosas. En dos de los casos, mostraron un importante crecimiento vegetante hacia la cavidad oral (patrón exofítico) aunque también invadían el corion subyacente en profundidad, formando islotes o cordones irregulares de células tumorales. Sin embargo, los carcinomas de células escamosas desarrollados en el otro animal de este grupo, tenían un crecimiento predominantemente exofítico y sólo observamos microinvasión del corion.
Gilmore (27) describió acúmulos de linfocitos en la lámina propia de los animales tratados con ácido retinoico, especialmente en aquellos que también recibían el tratamiento con DMBA, presentando uno de estos animales un denso infiltrado linfocitario que sugería linfoma.
En el grupo II, correspondiente a los animales a los que administramos el DMBA de modo individualizado, las neoplasias desarrolladas por tres de los animales, correspondieron a carcinomas de células escamosas. En este caso, dos animales mostraban tumores con un crecimiento predominantemente exofítico con microinvasión focalizada y sólo en uno de ellos, los carcinomas crecían invadiendo el corion en profundidad.
En cuanto al volumen tumoral, observamos importantes diferencias entre estos dos grupos (II y III), aunque no fueron estadísticamente significativas, probablemente debido al tamaño de la muestra. De tal modo que, en los animales del grupo IV, se desarrollaron las dos neoplasias de mayor volumen de todos los grupos, con 586,1 mm3 y 471 mm3 respectivamente, y las otras dos neoplasias correspondientes a este grupo también alcanzaron un gran volumen (182,2 mm3 y 62,8 mm3); mientras que los volúmenes tumorales desarrollados en los animales del grupo II fueron de 282,6 mm3, 153,86 mm3 y 16,75 mm3.
En la bibliografía, existen diversos trabajos en los que el desarrollo de los tumores va precedido de lesiones precancerosas, algunas de ellas en forma de placas blancas similares a la leucoplasia oral de los humanos tanto macro como microscópicamente. De hecho, este modelo ha sido calificado como idóneo para estudiar todo el espectro de lesiones de la carcinogénesis oral, debido al desarrollo de lesiones premalignas previas a la presentación de los tumores invasores (28,22,29,3). En nuestro experimento, sin embargo, no ocurrió tal fenómeno ya que las neoplasias se originaron en ausencia de lesiones premalignas previas macroscópicamente relevantes, aunque desde el punto de vista microscópico sí se apreciaban lesiones precancerosas en los bordes de las neoplasias.
Las conclusiones que extraemos de nuestro experimento son:
En el modelo I (cobayas) no se desarrollaron neoplasias malignas con las dosis de carcinógeno administradas y el tiempo de tratamiento empleado, mientras que en el modelo II (hámster), ocurrió la carcinogénesis oral tras la aplicación del carcinógeno. Las neoplasias se originaron de forma temprana y además, mostraban microscópicamente un espectro lesional semejante al de la carcinogénesis oral humana, por lo que consideramos este modelo idóneo para el estudio de la etiopatogenia del cáncer oral así como para el ensayo de diferentes tratamientos frente a esta enfermedad.
Por otra parte, el etanol ha demostrado efecto promotor de la carcinogénesis en el modelo II, puesto que los tumores desarrollados en los animales tratados con etanol y DMBA, fueron más numerosos, agresivos y de mayor volumen que los desarrollados en los animales que no lo ingerían.
BIBLIOGRAFÍA
Pereira MC, Oliveira DT, Landman G, Kowalsky LP. Histologic subtypes of oral squamous cell carcinoma: prognostic relevance. J Can Dent Assoc 2007; 73: 339-44.
Scully C, Bagan JV. Recent advances in oral oncology. Oral Oncol 2007; 43: 107-15.
Vairaktaris E, Spyridonidou S, Papakosta V, Vylliotis A, Lazaris A, Perrea D, Yapijakis C, Patsouris E. The hamster model of sequential oral oncogenesis. Oral Oncol 2008; 44: 315-24.
Salley JJ. Experimental carcinogenesis in the cheek pouch of the Syrian hamster. J Dent Res 1954; 33: 253-62.
Feng L, Wang Z. Chemopreventive Effect of Celecoxib in Oral Pre-cancers and Cancers. Laryngoscope 2006; 116: 1842-5.
Kandarkar SV, Sawant SS. The effect of Vitamin C on the hamster cheek pouch treated with the water soluble carcinogen 4-nitroquinoline-1-oxide (4NQO). Eur J Cancer B Oral Oncol 1996; 32B: 230-7.
Kanojia D, Vaidya MM. 4-Nitroquinoline-1-oxide induced experimental oral carcinogénesis. Oral Oncol 2006; 42: 655-67.
Dachi SF. Effects of polyoxyethylene sorbitan monosterate (Tween 60) upon experimental oral carcinogenesis in the hamster. J Dent Res 1962; 41: 476.
Silberman S, Shklar G. The effect of a carcinogen (DMBA) applied to the hamster’s buccal pouch in combination with croton oil. Oral Surg 1963; 16: 1334.
Tang XH, Knudsen B, Bemis D, Tickoo S, Gudas LJ. Oral cavity and esophageal carcinogenesis modelled in carcinogen-treated mice. Clin Cancer Res, 2004; 10: 301-13.
Morris AL. Factors influencing experimental carcinogenesis in the hamster cheek pouch. J Dent Res 1961; 40: 3-15.
Shklar G, Eisenberg E, Flynn E. Immunoenhancing agents and experimental leukoplakia and carcinoma of the hamster buccal pouch. Prog Exp Tumour Res 1979; 24: 1269-82.
Brandizzi D, Gandolfo M, Velazco ML, Cabrini RL, Lanfranchi HE. Clinical features and evolution of oral cancer: A study of 274 cases in Buenos Aires, Argentina. Med Oral Patol Oral Cir Bucal 2008; 13: E544-8.
Renstrup G, Smulow JB, Glickman I. Effect of chronic mechanical irritation of chemically induced carcinogenesis in the hamster cheek pouch. JADA 1962; 64: 770-9.
Perez MA, Raimondi AR, Itoiz ME. An experimental model to demonstrate the carcinogenic action of oral chronic traumatic ulcer. J Oral Pathol Med 2005; 34: 17-22.
Herschfus L. The synergistic effect of alcohol and tobacco abuse on oral cancer. J Mich Dent Assoc 1991; 73: 18-9.
Gomez S, Vicente V, Ochotorena MM, Hernandez-Gil A. Melanocytic carcinogenesis in albino guinea pigs. Pigment Cell Res 1988; 1: 390-6.
Vicente V, Gomez S. Ultrastructural study of melanocytic lesions in albino guinea pigs induced with 7,12-dimethyl-benzanthracene. Ultrastruct Pathol. 1989; 13: 43-53.
Gomez S, Vicente V. Protein S-100 immunostaining as a diagnostic tool for DMBA-induced melanotic lesions. Histol Histopathol 1989; 4: 201-4.
Elzay RP. Local effect of alcohol in combination with DMBA on hamster cheek pouch. J Dent Res 1966; 45: 1788-95.
Subapriya R, Bhuvaneswari V, Nagini S. Ethanolic neem (Azadirachta indica) leaf extract induces apoptosis in the hamster pouch carcinogénesis model by modulation of Bcl-2, Bim, caspase 8 and caspase 3. Asian Pac J Cancer Prev 2005; 6: 515-20.
Marefat MP, Albright JT, Shklar G. Ultraestructural alterations in experimental lingual leukoplakia. Oral Surg Oral Med Oral Pathol 1979; 47: 334-42.
Kandarkar SV, Sirsat SM. Developmental morphology of hamster cheek pouch epithelium. Folia Morphol 1984; 32: 345-50.
Hardy MH, Vrablic OE, Covant HA, Kandarkar SV. The development of the Syrian hamster cheek pouch. Anat Rec 1986; 214: 273-82.
Freedman A, Shklar G. Alcohol and hamster buccal pouch carcinogenesis. Oral Surg Oral Med Oral Pathol 1978; 46: 794-805.
Nachiappan V, Mufti SI, Eskelson CD. Ethanol-mediated promotion of oral carcinogenesis in hamsters: association with lipid peroxidation. Nutr Cancer 1993; 20: 293-302.
Gilmore W, Giunta JL. The effect of 13-cis-retinoic acid on hamster buccal pouch carcinogenesis. Oral Surg Oral Med Oral Pathol 1981; 51: 256-65.
Everson JW, MacDonald DG. Quantitative histological changes during early experimental carcinogenesis in the hamster cheek pouch. Br J Dermatol 1978; 98: 639-44.
Zhou ZT, Yang Y, Ge JP. The preventive effect of salvianolic acid B on malignant transformation of DMBA-induced oral premalignant lesions in hamsters. Carcinogenesis 2006; 27: 826-32.