
Vol. 42, n.º 2, 2009
REVISTA
ESPAÑOLA DE
Vol. 42, n.º 2, 2009 |
REVISIONES
Olga Ferrer-Roca, Francisco Marcano
Cátedra UNESCO de Telemedicina. CATAI. Facultad
de Medicina. Universidad de la Laguna. Tenerife.
www.teide.net/catai
RESUMEN
Al igual que el resto de los servicios hospitalarios, el de anatomía patológica requiere un control de calidad y una gestión automatizada. Lo habitual es que dentro del PIS (pathology information system) se automaticen las muestras, imágenes e informes y que se incorpore la PI (pato-informática), D-AP (anatomía patológica digital), la e-AP (anatomía patológica electrónica), TP (tele-patología) , la F-AP o fármaco-patología, la autopsia virtual y todo tipo de investigación translacional dentro del PMIS (pathology management information system).
Al no tener un estándar especifico de calidad, esta queda a cargo de la ISO-13485:2003 para servicios y dispositivos médicos y la ISO 17025:2005 en los aspectos técnicos; mientras que en los procesos automatizados y cuantificables, la normativa aplicable seria la UNE: ISO-15198:2003 ligada al PIS y a los dispositivos con software, que se ve directamente afectado por la nueva directiva comunitaria.
En los procedimientos no estandarizados, el criterio de los usuarios sobre su finalidad es el que prevalece. Según nuestro criterio, los requerimientos de control de calidad de una preparación virtual no se cumplen en la mayoría de los sistemas comerciales.
Las innovaciones que se avecinan auguran la «anatomía patológica en solitario» (solo-patología) en un entorno robotizado bajo un estricto control de calidad que incluya el soporte diagnostico a distancia para minimizar el grado de error diagnostico.
Palabras clave: Pato-informática, solo-patología, control de calidad, patología automática.
SUMMARY
As in other hospital departments, histopathology and morbid anatomy require automation and quality control. Usually the PIS (Pathology information system) automates samples, images and reports and progressively incorporates PI (Pathology informatics), D-PATH (digital pathology), e-PATH (electronic pathology), PPH (Patho-pharmacology), virtual autopsy and in general all types of translational research in the PMIS (pathology management information system).
Not subject to a specific standard, quality control follows ISO-13485:2003 on services and medical devices, ISO 17025:2005 on technical aspects and ISO-15198:2003 for automatic and quantifiable procedures that, as medical software, is regulated by the new European directive on medical devices.
For non-standardized procedures, users’ requirements for testing and calibration are essential. In our opinion, quality control requirements for virtual slides are not fulfilled in the majority of commercial systems.
Future innovations in «solo-pathology» should see automated pathology laboratories, regulated by strict quality control, which include a telepathology backup to minimize diagnostic errors.
Keywords: Patho-informatics, «solo-pathology» quality control, automatic pathology.
1. INTRODUCCIÓN
ISO define la acreditación como el procedimiento mediante el cual un organismo autorizado da reconocimiento formal de que una organización o individuo es competente para llevar a término tareas específicas. Mientras que certificación es el procedimiento mediante el cual una tercera parte da una garantía escrita que un producto, proceso o servicio es conforme a unos requisitos especificados que se registran como tales.
La acreditación tiene en cuenta los procedimientos
técnicos del laboratorio,
mientras que la certificación analiza los
requerimientos de gestión y de procedimiento escritos.
Para los laboratorios sanitarios: 1) Los requisitos de gestión quedan recogidos en la normal ISO 9001:20001 o su equivalente la ISO-13485:2003 (1) para servicios y dispositivos médicos. 2) Los requisitos técnicos están dentro de la normal ISO 17025:2005 (2) para testeo y calibración, la 3) la norma ISO 15189:2007 de calidad y competencia de los laboratorios clínicos y microbiológicos engloba a ambas y 4) finalmente la norma ISO/TS 22367:2008, son las especificaciones técnicas de gestión para la reducción de riesgo y mejoras permanentes en laboratorios.
La norma ISO 15189 se aplica a los laboratorios clínicos y de
microbiología,
peculiares porque sus informes tienen resultados objetivos y no
llevan interpretación diagnóstica.
La norma ISO 15189 se refiere a los rasgos y requerimientos característicos de los laboratorios y abarca tanto los requisitos de gestión basados en la ISO 9001 como los técnicos basados en la ISO 17025. Aunque no fue pensada como una guía para la acreditación puede usarse con este propósito (3). En ella se establece una dirección tecnica responsable de calidad (DTC) que fija las funciones y responsabilidades del personal, designando sustitutos, pero que además debe asegurar la competencia tecnica del mismo con una formación adecuada. La DTC debe definir la política y objetivos (Objeto del servicio, nivel de servicio, objetivos del sistema de gestión de calidad) y debe incluir los controles (3,4) adecuados tanto control interno como externo (que asegure un seguimiento de: calibración instrumentos, reactivos y sistemas), todo ello documentado en un manual de calidad.


En la actualidad la diferencia entre los laboratorios clínicos y los de anatomía patológica se ha ido reduciendo debido a la progresiva automatización (5,6) y evaluación objetiva que ya puede aplicarse a muchos de los procesos de diagnostico anatomopatológico (FISH-HISH-citogenética y marcadores tumorales, IHQ, etc…) listados en el catálogo de procedimientos de diagnostico en patología cuantitativa (7); además de en la emergente sub-especialización en farmacopatología, dedicada a la detección y evaluación de dianas terapéuticas, con o sin una estructura diagnostica GRID de computación distribuida (8,9).
En cualquier caso los servicios de anatomía patológica deben cumplir los estándares de calidad y control de riesgos que establece la nueva directiva comunitaria de aparatos médicos (10-13). La necesidad de nuevas tecnologías tecnifica el laboratorio y obliga a considerar el papel del servicio de PI o pato-informática (14,15) para la gestión y control de calidad de la anatomía patológica digital (D-AP) la electrónica (e-AP), la tele-patología (TP), la autopsia virtual, la fármaco-patología y la investigación translacional sobre la etiología y fisiopatología de las enfermedades. Este se encarga del control del LIS2 (16), o en este caso del PIS3 incluido los flujos de datos y muestras, la reproducibilidad y trazabilidad las imágenes digitales y su calidad diagnostica, la integración con el HIS4 y el PACS5, y su accesibilidad para el trabajo cooperativo a distancia (sala autopsias, quirófano inteligente etc…), clasificación y minería de datos y de imágenes, anonimización, altas en los biobancos, control electrónico integrado del flujo y la calidad o la enseñanza a distancia etc... Aspectos la mayoría de ellos no considerados en los catálogos de competencia de Anatomía Patológica (17).
Para ser más exactos, la denominada pato-informática arranca de Tom Lincoln y Don Connelly en los 80, que definieron las bases teóricas y técnicas de la anatomía patológica dentro de la informática. En 1987 Ralph Korpman resaltó el papel del patólogo en la informática medica y en 1990 Bruce Friedman la denominó «pathology informatics» (PI). Para entonces 1993 Greg Buffone y Bob Beck la propusieron como una sub-especialidad de la anatomía patológica debido a su trascendencia en la optimización de los sistemas de información. Y finalmente en 2002, Friedman llevó a cabo la primera reunión en la que definió la subdisciplina de «pathology bioinformatics» dentro del campo de la Bioinformática. La informática en anatomía patológica se encarga preferentemente.
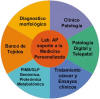
Fig. 1:
Cometido de la pato-informática. GLP= good laboratory practice: PIMS=
pathology informatics management system. Ver siglas en el texto.
1. Los fundamentos de las enfermedades (etiología y fisiopatología) aunando la anatomía patológica, la bioquímica y farmacología (investigación translacional).
2. La seguridad y confidencialidad de los datos del paciente así como en su acceso y responsabilidades en el ámbito clínico.
3. Los bancos de tejidos, su gestión y su misión diagnostica y de provisión de biomuestras.
4. Los estándares e intercambio de datos debido a que la misión fundamental de la pato-informática es translacional e interdisciplinaria.
5. El acceso a distancia por web y la gestión de grandes bases de datos longitudinales y relacionales a partir de datos clínicos y de investigación estandarizados.
Aun considerando que hoy en día tenemos un gran numero de estándares, esenciales en los concursos públicos de equipamiento, todos estos procesos requieren, por su complejidad, especialistas en la materia (18), ya que junto a la gestión de bases de datos hemos de considerar el estándar Plug & Play IEEE 11073 que abarca desde la nomenclatura a la transmisión inalámbrica de los datos del paciente y su relación con los estándares de imágenes DICOM y las propuestas de integracion del grupo de IHE (Integrated Health Care enterprise).
Los elementos que estudiaremos en profundidad en este articulo y que se ven afectados por la normativas anteriormente citadas son fundamentalmente: 1) Control de calidad ISO: UNE 15189:2007. 2) Trazabilidad de las muestras dentro y fuera del periodo asistencial. 3) La norma UNE: EN 60601-1:2008 y los subsistemas electrónicos programables o PESS. 4) Nueva directiva comunitaria para PSANI. 5) Peculiaridades de los archivos de imágenes virtuales, macro y microscópicas. 6) Ontología, diagnósticos y minería de datos. 7) El HIS y los estándares Plug and Play/DICOM/ IHE.
De estos se trataran los aspectos más innovadores ligados a las nuevas tecnologías, incluido el futuro de la patología en solitario6 (solo-pathology), gracias a la robotización y automatización de los laboratorios de anatomía patológica.
2. CONTROL DE CALIDAD BAJO LA NORMA ISO: UNE 15189:2007
La norma ISO: UNE 15189 para la certificación y la acreditación de los laboratorios clínicos y de microbiología tan solo sería de aplicación en la Anatomía Patológica en aquellos los procedimientos diagnósticos de patología cuantitativa y fármaco-patología, y aun así tendrían peculiaridades respecto al tipo de material de las muestras utilizadas por su carga genética que las convierte en biomuestras fuera del periodo asistencial de 5 años (18).
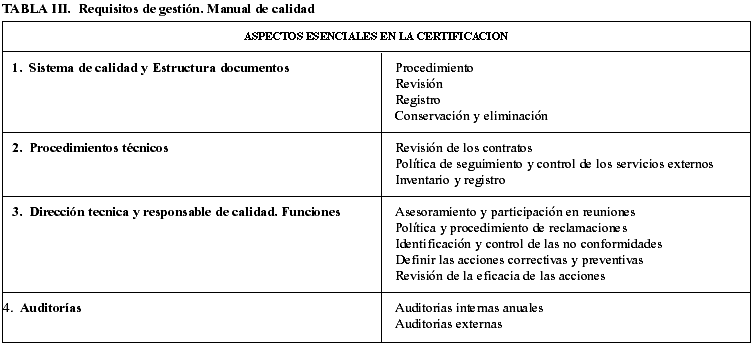
A pesar de ellos algunos laboratorios han cursado su acreditación por esta vía. En las tablas III y IV incluimos un listado de requisitos adaptados a un laboratorio de anatomía patológica moderno.
La norma técnica de testeo y calibración ISO 17025 que se
actualizó en 2005(2)
obliga a tener personal técnico y de gestión que
además de sus otras
responsabilidades tenga la autoridad y los recursos
necesarios para llevar
a cabo la puesta a punto, mantenimiento y mejora del
sistema de control técnico
y detectar los desvíos que puedan producirse en los
procedimientos de testeo
y/o calibración e iniciar acciones para prevenir y
minimizar estos desvíos.

Específicamente se menciona que uno de los mecanismos que deben utilizarse para ello es el entrenamiento, adecuado y en profundidad, en los aspectos técnicos del personal que haga uso de los mismos.
Como aspectos novedosos se incluyen: la calidad de las imágenes para el diagnóstico a distancia, o para la cuantificación. Puesta a punto y control de los sistemas de trazabilidad de la muestra (ver apartado 3). Introducción y calibración de las técnicas automáticas de procesado, tinción, incluida inmunohistoquímica, escaneado automático y archivo de preparaciones, screening citológico automático, diagnostico sobre imagen digital. Además de los sistemas de reporte automático de los informes con reconocimiento de voz, robotización de los procedimientos y respuesta a la voz, solo-pathology7, etc... (6,19-26).
Cuando la metodología utilizada todavía no tiene estándares reconocidos (27), como ocurre con muchos de los procedimientos en anatomía patológica, debe utilizarse el principio de los acuerdos entre usuarios, estableciendo claramente cuales son los requerimientos de los mismos y cual es la finalidad del testeo y la calibración.
Por ejemplo, según nuestra opinión (28): «la finalidad de una preparación virtual es obtener un archivo digital de la imagen completa de la preparación que sirva como diagnóstico y por lo tanto contenga información adicional que no desvirtúe el color de la imagen mostrada en el monitor, se pueda cuantificar en ella, tenga información tridimensional en caso necesario(enfoque-eje Z), soporte un zoom digital con calidad diagnóstica y una gestión rápida a distancia que permita visualizar las ROIs (regiones de interés), pueda usarse en los procedimientos de minería de imágenes y ocupe el menor espacio posible con el fin de que pueda ser gestionada ágilmente por el PIS, y el HIS y PACS hospitalario, y que pueda desligarse de la información personal del paciente, dependiendo de si es una muestra asistencial o una biomuestra». De acuerdo con esta definición la mayoría de los sistemas del mercado no pasarían un control de calidad.
3. TRAZABILIDAD DE LA MUESTRA DENTRO Y FUERA DEL PERIODO ASISTENCIAL
El periodo asistencial tiene un mínimo de trazabilidad de 5 años o bien siempre, si es de utilidad asistencial. Fuera del periodo asistencial es una muestra biológica que ha de disociarse y mantener su trazabilidad durante 30 años (18).
Dado que en el procesado desde su alta en el HIS o en el PIS (fig. 2) hasta su diagnóstico y almacenamiento asistencial y/o como biomuestra va ligado a uno o varios responsables (cirujano, enfermera quirófano, celador, responsable recepción, técnico, técnico especialista, residente, adjunto etc.), el UI (Unique identifier) del personal involucrado debe quedar registrado a ser posible automáticamente mediante etiquetas RFID (radiofrequency identification) activas o pasivas, todavía algo caras (0,03-0,64 euros).

Fig. 2:
PIS o sistema de información en anatomía patológica con trazabilidad por código
de barras y/o RFID (identificación por radio frecuencia).
La técnica es muy útil para localizar preparaciones, piezas o bloques (29), en armarios inteligente o dependencias con portales de detección; algo parecido a lo que ocurre con la ubicación de camillas y pacientes en hospitales robotizados. Según el tipo de etiqueta y su chip, este es capaz de detectar el estado de la cadena de frío de la biomuestra.
Hoy en día Hitachi fabrica polvo RFID de tamaño micrométrico (50 µ) cuya funcionalidad usando los reactivos de laboratorio ha de comprobarse.
Dependerá de la política hospitalaria saber qué servicio va a ser responsable de dar de alta el material en la base de datos de biobancos, una vez adquiera la categoría de biomuestra.
4. NORMA UNE: EN 60601-1:2008, LOS PESS Y LAS TELECOMUNICACIONES
Los equipos, sistemas médico o productos sanitarios (PS) que contiene uno o más subsistemas electrónicos programables (PESS) vienen controlados por la norma UNE EN 60601-1:2008. Y es un PESS todo sistema basado en una o más unidades centrales de proceso, incluyendo su software e interfaz.
Aunque los requisitos para el software médico vienen especificados en el informe técnico de gestión riesgo para software medico AAMI-TIR32, del que se está preparando la versión internacional IEC 80002, los programas informáticos son sistemas para los que resulta prácticamente imposible su verificación total. Ello hace que los procesos que incluyen software deban clasificarse como especiales y tengan que validarse antes de su uso rutinario, por si pudieran causar daños al paciente u operador (IEC 62304:2006). Y no solo han de cumplir las normas de productos sanitarios sino que se ha de tener garantía de seguridad básica y de funcionamiento esencial.
Es decir, no solo no han de producir daño, sino que han de demostrar que son eficaces.
En la nueva directiva comunitaria (ver apartado 5), las telecomunicaciones están contempladas dentro de los sistemas electromédicos cuando se conectan a un PS también denominado MDDS (Medical Device Data System) según la FDA9. Eso hace que además de cumplir las normas de instalación, de reparación y de compatibilidad electromagnética, tengan que seguir la norma IEC 60601-1/2005 3.ª edición prevista armonizar el 12 septiembre de 2009.
En los casos de integracion, el agrupador debe asegurar que los productos médicos y no médicos integrados funcionan de acuerdo con la norma IEC 60601-1. El papel de agrupador lo puede hacer el propio hospital, el médico, un técnico etc. que va por lo tanto va ser responsable del mal uso del sistema en su conjunto, al igual que el Jefe de servicio va a ser responsable subsidiario.
En ocasiones hasta una compañía telefónica puede hacer el papel de integrador o incluso considerarse como fabricante de aparatos o productos sanitarios ya que:
Aparato sanitario es aquel que traspasa datos de un sistema sanitario a otro.
Gracias a esta normativa aseguramos que los sistemas de telemedicina van a tener garantías de funcionamiento adecuado en el entorno sanitario.
Las integraciones dentro del propio hospital para los equipos de electromedicina tienen que cumplir la reglamentación pero no necesitan una licencia o una reglamentación por terceros (Agencia española de medicamentos y productos sanitarios; http://www.agemed.es/).
5. LOS PSANI EN LA NUEVA DIRECTIVA COMUNITARIA D-2007/47/CE
Son de aplicación a los PS las siguientes directivas comunitarias: D 90/385/EEC-RD 634/93, sobre Productos Sanitarios Activos Implantables (PSAI) (p.e.: marcapasos); D 93/42/EEC-RD 414/96, por el que se regulan los Productos Sanitarios en general, entre los que se encuentran los PSANI o productos sanitarios activos no implantables (p.e: equipos de RX); Directiva 98/79/EEC-RD 1662/2000, para Productos Sanitarios de diagnóstico «in vitro» (p.e: kit de diagnóstico de la glucemia).
La nueva directiva 2007/47/CE incluye una nueva definición de producto sanitario que es especialmente importante en el entorno del laboratorio de anatomía patológica, ya que lo define como cualquier instrumento, dispositivo, equipo, programa informático, material u otro artículo, utilizado solo o en combinación, junto con cualquier accesorio, incluidos los programas informáticos destinados por su fabricante a ser utilizado para seres humanos con fines de: 1) diagnóstico, prevención, control, tratamiento o alivio de una enfermedad; 2) diagnóstico, control, tratamiento, alivio o compensación de una lesión o de una deficiencia; 3) investigación, sustitución o modificación de la anatomía o de un proceso fisiológico; 4) regulación de la concepción, y que no ejerza la acción principal que se desee obtener en el interior o en la superficie del cuerpo humano por medios farmacológicos, inmunológicos ni metabólicos, pero a cuya función puedan contribuir tales medios.
Para los productos sanitarios el etiquetado CE es obligatorio,
por lo que no
solo debe ser visible en los aparatos de laboratorio sino en el
software asociado al mismo.
En realidad y para aclarar la interpretación de lo que es un producto sanitario y su relación con los aparatos que tenemos en anatomía patológica es preferible acudir a la definición de MDDS que hace la FDA: Es un producto destinado a proporcionar uno o más de los siguientes usos:
1. Transferencia electrónica o intercambio de datos de productos sanitarios, sin alterar la función o los parámetros de cualquier equipo conectado.
2. Almacenamiento electrónico y recuperación de datos del equipo medico, sin alterar la función o los parámetros de los equipos conectados.
3. La presentación electrónica de datos de los equipos, sin alterar la función o los parámetros de cualquier equipo conectado.
4. La conversión electrónica de datos de producto sanitario de un formato a otro de acuerdo con una especificación establecida.
Los MDDS, NO pueden crear alarmas que no estuvieran en el equipo que conectan, NO pueden proporcionar por si mismos ninguna función de diagnostico o decisión clínica. Los MDDS pueden transmitir, intercambiar, almacenar, o recuperar datos en su formato original o pueden convertir de un formato a otro especificado.
El fabricante que coloca el marcado CE en sus productos para indicar que cumple todos los requisitos esenciales aplicables, está afirmando que puede proporcionar, durante toda su vida útil del producto, las garantías listadas en la tabla V.

Los fabricantes de software van a ser responsables durante todo la vida activa del producto. Como clase I o de bajo riesgo, no requerirán auditorias obligatorias salvo que haya una denuncia, pero como software medico van a estar regulados con la norma IEC 62304:2006.
Cuando entre en vigor la directiva, es decir en el año 2010, todos los sistemas de software, deberán tener etiquetado CE y proporcionar garantía de información (no podrá haber productos secretos); de seguridad (deberán haber sido testeado); de funcionalidad (con validación previa a su puesta en funcionamiento real); de calidad (deben tener un sistema de diseño de calidad ISO-13485). En caso contrario, solo podrán ser considerados como un demostrador.
Se prevé un embudo que obligara a la validación de todo el software existente en el mercado en cualquiera de los productos sanitarios, y si un laboratorio ha basado sus inversiones en productos sin etiquetado CE, pueden encontrarse en un grave problema de funcionalidad. Únicamente los productos estadounidenses que han pasado la FDA no van a plantear problemas con el etiquetado CE.
Estamos hablando de toda la anatomía patológica de cuantificación automática, los sistemas de digitalización de imágenes con finalidad diagnostica, la mayoría de los procedimientos de farmacopatología, los procedimientos de screening automático e incluso los sistema de telepatología (ver apartado 4).
Toda la detección automática de los parámetros analíticos
y creación
de alarmas por las que a partir de estos datos se toman
decisiones
requiere un análisis de conformidad con la reglamentación
vigente.
Si el sistema es un desarrollo o una integracion «in house» no tendría que obtener licencia, a menos que el servidor que controla y distribuye esta información sea de una empresa comercial con un NIF distinto al del hospital, lo que significa que es un sistema externalizado y por lo tanto que el proveedor externo debe tener los permisos y cumplir todas las reglamentaciones necesarias.
6. IMÁGENES VIRTUALES MACRO Y MICROSCÓPICAS
En un entorno gestionado eficientemente por el PIMS (pathology information management system) la totalidad de la captura de imágenes macro (21) y microscópicas virtuales o no, deberían estar integradas y anotadas automáticamente con la codificación SNOMED a partir de los informes anatomopatológicos dictados en sistemas con reconocimiento de voz especializados y el tipo de muestra especificado de la base de datos (ver apartado 7) (6,24,25).
La definición que nosotros hacemos de la preparación virtual y que vimos en el apartado 2, nos permite considerar la gestión de las mismas en un PACS y sustituir en parte los portas de cristal, pesados y con grandes problemas de almacenamiento. Para ello las imágenes virtuales deben tener menos de 2 GB (máximo permitible en DICOM), de ahí que la tecnica de SSVS (small size virtual slide) desarrollada por nosotros, se compruebe ideal (28) para la integracion al HIS y al PACS.
Ni que decir tiene que las imágenes de las autopsias virtuales pueden quedar igualmente integradas (30) y que las salas de autopsia van a convertirse en lugares con un flujo de trabajo similar al de los quirófanos de ultima generación u ORF (operating room of the future) con sistemas suspendidos en el techo y monitores de control en los brazos centrales o colgados de las paredes, comandados por voz o con paneles sensibles al tacto (fig. 3), que alteraran con sistemas de resonancia magnética (RM) transportables integrados con o sin posicionadores magnéticos. Esto obliga a re-diseñar las salas de autopsias, a considerar la protección radiológica en las mismas y su función en la re-ubicación de los sistemas de RM clínicos, obsoletos para el diagnostico clínico rutinario debido a las innovaciones tecnológicas, pero perfectamente útiles en el entorno de autopsias.
Las autopsias que hasta ahora han sido una fuente de enseñanza
morfológica
para los clínicos, y que ha caído en desuso debido a las técnicas de
imagen, se
convierte ahora en una fuente de enseñanza morfológica en la
interpretación
de las desviaciones radiológicas de la normalidad, igualmente
extraordinariamente
valiosa y por supuesto en un elemento esencial para la
pato-farmacología y la
investigación translacional, siempre que la gestión
de muestras se haga
con garantías técnicas de control de calidad.

Fig. 3:
Sistema de imágenes macroscópicas de autopsia. Macroview digital system™
http://www.milestonemed.com/mvoverview.php
Por ultimo la interconexión con los quirófanos inteligentes permitirá el diálogo directo con el cirujano en el acto quirúrgico y la visión del campo operatorio donde se ha tomado la biopsia o se sitúa la lesión, que puede incorporarse al HIS y a la petición electrónica de anatomía patológica.
La posibilidad de tener un sistema en red con audio y video bidireccional, así como un acceso a imágenes de archivo y on line a través de la web, asegura un trabajo cooperativo permanente esté donde estén los patólogos, además de con los quirófanos u otras dependencias hospitalarias con similares prestaciones en la red corporativa virtual. Sin embargo y dado que el diagnóstico se realiza por la imagen, los monitores diagnóstico habrán de cumplir estrictos criterios de calidad y las imágenes deberán contener información necesaria para adecuar el monitor de visión a los colores originales en la cámara de adquisición. En el caso de autopsias virtuales los monitores tendrán las mismas especificaciones que los monitores diagnósticos radiológicos.
La red de gestión interna es igualmente capaz de comprobar gracias al tracking del sistema el procesado de las muestras con sistemas ultra-rápidos y microondas que aceleran los procesos de diagnostico (19,20,29).
7. PIMS - ONTOLOGÍA Y MINERÍA DE DATOS
Los PIS y PIMS (pathology information management system) (31,32) incluye los procesos de alta, tracking, soporte para el diagnostico con reconocimiento de voz (33) integrado en red (interface de web), extracción automática de la nomenclatura medica (34-36) y clasificación ontológica, anotación automática de las imágenes etc... (fig. 2).
Las técnicas de interrogación de ontologías permiten acelerar los procesos de búsqueda de hechos, diagnósticos y anotaciones entre un número muy grande de muestras, interrelacionando casos y derivando hipótesis que pueden conducir a nuevos descubrimientos de relaciones en patologías o el tratamiento. Este acceso puede estar disponible a distancia en un entorno GRID como en el Shared Pathology Informatics Network (SPIN) http://spin.nci.nih.gov/ o en el Cancer Biomedical informatic grid (fig. 4) con un gran número de herramientas interoperables, modulares, validadas de código abierto y disponible gratuitamente.
![]()
Fig. 4:
En antes y el ahora de la anatomía patológica. Sacado de Cancer Biomedicals
informatic Grid. Tissue bank and pathology tools.
https://cabig.nci.nih.gov/workspaces/TBPT/tbpt-newcomer/workspaces/TBPT/TBPT_Newcomer_Introduction.ppt
Y es un elemento esencial en la farmacopatología y en la investigación translacional en la que se involucran un gran numero de especialidades y equipos de investigación (8,18).
8. LOS ESTANDARES IEEE11073, DICOM, IHE
El estándar IEEE11073 también denominado plug and play, tiene por finalidad que la integración de un aparato o sistema en el PIS sea tan simple como conectarse a la red, para luego poder ser controlado por el PIMS (pathology information management system), ya que todas las funciones y mensajes pasan a través del estándar y son perfectamente reconocibles debido a que tiene un formato normalizado. Su finalidad es que los profesionales sanitarios sólo deben realizar la conexión y los dos sistemas automáticamente negocian y configuren la conexión (como por ejemplo una memoria USB en un PC), que no precise configuración del puesto por técnicos, que haya interoperabilidad en todas las 7 capas del modelo OSI de comunicaciones y que sea independiente del software y hardware de fabricante.
El estándar incluye desde el leguaje 1073.1.X-Medical Device Data Language (MDDL) con su nomenclatura, su DIM (Domain information model) y la especialización según el aparato medico de que se trate, hasta la interconexión y los gateways de aplicación conteniendo agentes. Existe igualmente una extensión especifica para los laboratorios de análisis clínicos el 11073-9xxxx NCCLS (National Committee for clinical laboratory standards) http://www.clsi.org/ que probablemente se extienda a los de anatomía patológica.
El control manual de todos los procedimientos y sistemas de un laboratorio de anatomía patológica con la complejidad mostrada en las figuras 1 y 4, es imposible de llevarlo a cabo manualmente. De ahí que la gestión del mismo se realice con el PIMS y el estándar IEEE11073 que permite recibir información centralizada de la totalidad de los sistemas de laboratorio. Estaríamos poniendo a punto un GLP o Good Laboratoy practice. Esta gestión como en algunas otras aplicaciones puede centralizarse en un panel de control multifunción donde comprobar la ocupación del sistema, el tracking de las muestras, la disponibilidad de personal etc...
Inicialmente el principio del GLP requería una validación. Hoy en día y con la nueva normativa comunitaria que vimos en el apartado 5 es una cuestión mandataria para obtener la certificación CE, e igualmente necesaria en la integracion de los productos «in house». De acuerdo con el GAMP o guía para la validación de sistemas automáticos, los servicios hospitalarios de bioingeniería deben comprobar los sistemas operativos, el hardware, el software embebidos en los sistemas, COTS, los sistemas configurables y las adaptaciones realizadas en el PIMS
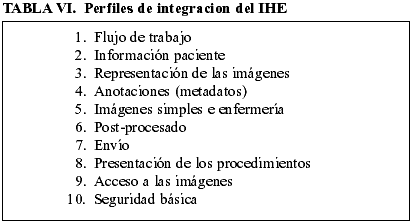
Con independencia de que el proceso pueda requerir una validación del costo-beneficio, el hecho real es que de la estrategia de ERP (Enterprise Resource planning) esta siendo definida por la IHE (Integrated health enterprise) (37). Para ellos junto al estándar Plug & Play hemos de diseñar varios perfiles que quedan recogido en la tabla VI.
En el caso de la Anatomía Patológica existe un grupo especialmente activo dedicado fundamentalmente a analizar el flujo de trabajo y a las imágenes en anatomía patológica: La IHE-Pathology.
Están ya diseñados en Anatomía Patológica por el IHE el Marco Técnico y los Perfiles de integracion. En el primero y en su volumen 1 se definen los perfiles, actores y transacciones y en el volumen 2 la descripción técnica de cada una de estas transacciones con los mensajes correspondientes. Igualmente han conseguido un grupo DICOM WG26 en anatomía patológica, haciendo especial mención a los aspectos de integracion en el PACS, HIS, consistencia en la representación de la imagen, almacenamiento, compresión etc… (38).
Su primer documento es el suplemento 122 del estándar DICOM también denominado «Identificación de la muestra y revisión de las clases SOP de Anatomía Patológica». Los services object pairs (SOP) son los elementos esenciales en el DICOM, y representan la combinación entre la información del objeto (IOD) y los servicios asociados al mismo. Los nuevos IODs aceptados en el Suplemento 15 del estándar DICOM, también denominado suplemento de microscopia son: los GM-Visible Light Microscopic images, los SM-Visible Light slide-coordinates microscopic images y los XC-Visible Light photographic images (39).
Los nuevos avances tecnológicos deben incorporarse urgentemente al PIS. Las técnicas de TMA (Tissue Micro Array) y la hibridación in situ (40) o la farmacopatología (41) ya tienen modelos propuestos. E igualmente otros grupos como los del Laboratoy Imaging digital Project (LDIP) (42) al igual que los grupos GRID (43) de cáncer utilizan extensamente la anotación de metadatos con agentes de acuerdo con la ISO 11179 (44) y evitan usar el estándar DICOM por su complejidad.
La estandarización de los flujos, modalidades y formatos nos permitirá llevar a cabo una gestión integrada del PIMS que de otro modo debería integrarse «in house», con la consiguiente complejidad para asegurar un GLP y un control de riesgo.
9. CONCLUSIONES
No debería existir ya laboratorio de anatomía patológica que no se preparara para la gestión de bio-muestras, que no considerara el servicio de pato-informática y el de fármaco-patología, que no digitalizara sus archivos de preparaciones, que no considerara implantar las autopsias virtuales y que no automatizara la gestión de muestras e informes.
Todo ello en un entorno estandarizado y de acuerdo con la legislación vigente y ayudada con las herramientas de la sociedad de la información, con el fin de garantizar la calidad de la asistencia.
Estos aspectos técnicos y científicos deben igualmente formar parte de la formación de los médicos generalistas y por supuesto de los especialistas en anatomía patológica.
Por ultimo la robotización del laboratorio y el soporte diagnostico a distancia deben preparar a los nuevos especialistas en los aspectos de la practica de la anatomía patológica en solitario (solo-patología).
BIBLIOGRAFÍA
ISO 13485:2003. Disponible en http://www.tecnologias-sanitarias.com/calidad/iso13485-2003/
ISO 17025:2005. Disponible en http://www.aiha.org/1documents/lab/lqapnews03-0406.pdf
Giménez Mas JA, Alvarez Alegret R, Alfaro Torres J. El control interno y externo de la calidad de las técnicas inmunohistoquímicas en relación con la Norma UNE-EN ISO 15189:2003. Ponencia presentada en: 23 Congreso de la Sociedad Española de Anatomía Patológica; 8-10 mayo 2007; Tarragona, España. Disponible en: http://www.seapcongresos.com/2007/clubes/gestion/gimenez.htm
CECP. Programa de control externo de calidad en patología Rev Esp Patol 2003; 36: 347-9. Disponible en http://www.conganat.org/seap/cecp/index.htm
Virtual Lab Automation. A Quantum Leap in IT Cost Reduction and Application Development Process Improvement. VMware, Inc. 2006. Disponible en http://www.vmware.com/pdf/virtual_lab_automation_whitepaper.pdf
García Rojo M. Management and Automation in Pathology Laboratories. Ponencia presentada en: 5th Internet World Congress for Biomedical Sciences Inabis’98. 1998. Disponible en http://www.mcmaster.ca/inabis98/rojo/rojo0500/two.html
INSALUD Dirección General de Organización y Planificación Sanitaria Subdirección General de Planificación e Información Sanitaria. Cartera de Servicios. Catálogo de Técnicas y Procedimientos de la Cartera de Servicios de Anatomía Patológica. Agosto de 2000. Disponible en http://www.conganat.org/seap/informacion/catalogo.htm
Schmitt FC (2007) Image Biobanking: Biomaterial to personalized cancer diagnosis and treatment. En Quality control in Telemedicine. Biobanking. Ferrer-Roca O. Ed. Ediciones Catai. Tenerife. Pp: 68-72.
Tobias J, Chilukuri R, Komatsoulis GA, Mohanty S, Sioutos N, Warzel DB, Wright LW, Crowley RS. The CAP cancer protocols – a case study of caCORE based data standards implementation to integrate with the Cancer Biomedical Informatics GRID. BMC Med Inform Dec Mak 2006; 6: 25-44.
ISO/IEEE 11073 o estándar plug & play. Disponible en http://www.ieee1073.org/
IEC 60601-1: 2006. Seguridad en los equipos electromédicos incluyendo los PESS o subsistemas electrónicos programables. Disponible en http://www.tecnologias-sanitarias.com/electromedicina/en60601-1.htm; http://www.tecnologias-sanitarias.com/electromedicina/IEC60601-1_ed3-info.pdf
ISO 14971:2007 Aplicación de la gestión de riesgos a los productos sanitarios. Disponible en http://www.tecnologias-sanitarias.com/iso14971/index.htm
DIR 2007/47/EC Nueva directiva sobre equipos médicos. Disponible en http://en.wikipedia.org/wiki/Medical_device
Pathology-informatics. Disponible en http://www.pathologyinformatics.org/; http://path.upmc.edu/cpi/
Becich MJ, Gilbertson JR, Gupta D, Grzybicki DM, Raab SS. Patient Safety and Healthcare Research: The Critical Role of Path Informatics in Error Reduction and Quality Initiatives. Clin Lab Med 2004; 24: 913-43.
Pearson S, Balis UJ, Fuller J, Kowalski B, Locke AP, Tillman D, Vantu QH. Managing and validating laboratory information systems; approved guideline. Clinical and Laboratory Standards Instititute document AUTO8-A 2006; 26 (36).
Catalogo nacional de calificación profesional. Familia profesional de sanidad. Anatomía patológica y citología. BOE 238 5 Octubre 2005. Disponible en http://www.mepsyd.es/educa/incual/pdf/2/SAN_125_(5).pdf
Ferrer-Roca O. Departamento de Anatomía Patológica a tenor de la legislación vigente. Rev Esp Patol 2009; 42: 17-23.
Leong AS, Leong FJ. Strategies for laboratory cost containment and shortage of pathologist. Centralized pathology laboratories with microwave stimulated microprocessing and telepathology. Pathology 2005; 37: 5-9.
Morales AR, Essenfeld H, Essenfeld E, Duboue M, Vincek V, Nadji M. Continuous-specimen-flow, high throughput, 1-hour tissue processing: a system for rapid diagnostic tissue preparation. Arch Pathol Lab Med 2002; 126: 583-90.
PathSuite, Macro Path. Disponible en http://www.diaginc.com/pathstand/pathstation.php; http://www.milestonemed.com/mdoverview.php
Auto slide preparation system. Disponible en http:// www.kurabo.co.jp/bio/English/as200.html
Hersh, W, Muller H, et al. Advancing biomedical image retrieval: development and analysis of a test collection. J Am Med Inform Assoc 2006; 13: 488-96.
Liu K, Mitchell KJ, Chapman WW, Crowley RS. Automatic clinical annotation in tissue bank specimen. Automating Tissue Bank Annotation from Pathology Reports – Comparison to a Gold Standard Expert Annotation Set. AMIA Annu Symp Proc 2005:460-4.
World Intellectual property organization: WO/2001/098774. Systems for automated and remote histological analysis and new drug assessment. Disponible en http://www.wipo.int/pctdb/en/wo.jsp?gIA=IL2001000561&DISPLAY=DESC
Ho J, Parwani AV, Jukic DM, Yagi Y, Anthony L, Gilbertson JR: Use of whole slide imaging in surgical pathology quality assurance: design and pilot validation studies. Hum Pathol 2006; 37: 322-31.
Dhurandhar N, Cramer H, Gallo LN, Kurtycz DFI, Moroz K, Plowden K, Prey M, Radcliffe G, Selvaggi SM.(2001) Papanicolau technique. Approved guidelines. 2nd Ed. NCCLS-GP15A2 Clinical and Laboratory Standards Institute 21 (17). Disponible en http://www.clsi.org/source/orders/free/gp15-a2.pdf
Ferrer-Roca O. Marcano F, Quintana JJ. (2008) Small Size Virtual Slides in Pathology. Virchows Arch 2008; 452 (suppl 1): s9-s10.
Syscan and Sybase RFID pathology system. Disponible en http://www.sybase.com/products/rfidsoftware; http://www.syscan.com/asset_management.aspx
MJ. Thali «Virtopsy: Virtual Autopsy», in Personalizad virtual medicine: p-health, O. Ferrer-Roca Ed. Tenerife: Catai Editions; 2005. p. 159-62.
CoPATHplus solution. Disponible en http://www.cerner.com/public/Cerner_3.asp?id=30881
Apollo Path-PACS. Disponible en http://www.apollopacs.com/; http://www.apollopacs.com/pathpacs
Speach recognition in pathology. Disponible en http://www.escription.com/products/index.html; http://www.nuance.com/dictaphone/products/powerscribe/pathology/
Ruch P, Tbahriti I, Gobeill J, Baud R, Lovis C. & Geissbühler A. Automatic Assignment of SNOMED Categories: Preliminary and Qualitative Evaluations. Semantic mining conference on SNOMED CT. Disponible en http://www.hiww.org/smcs2006/proceedings/5RuchSMCS2006final.pdf
Beckwith BA, Mahaadevan R, Balis UJ, Kuo F. Development and evaluation of an open source software tool for the identification of pathology reports. BMC Med Inform Decis Mak 2006; 6: 12-22.
Moore GW, Berman JJ. Performance analysis of manual and automated systemized nomenclature of medicine (SNOMED) coding. Am J Clin Pathol 1994; 101: 253-6.
IHE in pathology. Disponible en http://wiki.ihe.net/index.php?title=Pathology
Horsch A. New aspects in DICOM standard. En Standards in Telemedicine. O. Ferrer-Roca Ed. Tenerife: Catai Editions; 2006. p. 36-41.
Horsch A. The DICOM standard. Basics and recent extensions. En Quality control in telemedicine. Biobanking. O. Ferrer-Roca Ed. Tenerife: Catai Editions; 2007. p 26-34.
Lee HW, Park YR, Sim J, Park RW, Kim WH, Kim JH. The Tissue Microarray Object Model A Data Model for Storage, Analysis, and Exchange of Tissue Microarray Experimental Data. Arch Pathol Lab Med 2006; 130: 1004-13.
Developing standards for recording, sharing and integrating data from antibody research. Disponible en http://www.antibodysociety.org/data/GIAATE_by_prof_Begent_09March2008.pdf
Berman JJ, Moore GW. (2006) LDIP (Laboratory digital image project): RDF data specifications: the simple alternative to complex data standards. Disponible en http://www.pathologyinformatics.org/Resources/jjb_gwm.pdf
GRID & metadata with ISO 11179. Disponible en https://cabig.nci.nih.gov/
ISO11179 Metadata Standard. Disponible en http://dublincore.org/documents/1999/07/02/dces/; http://www.ukoln.ac.uk/metadata/newsagent/metadata/; http://hpcrd.lbl.gov/SDM/XMDR/overview.html