
Vol. 42, n.º 1, 2009
REVISTA
ESPAÑOLA DE
Vol. 42, n.º 1, 2009 |
ORIGINALES
José I. López, Verónica Velasco, Francisco J. Ortega
Departamento de Anatomía Patológica. Hospital de
Cruces-Osakidetza. Universidad del País Vasco (EHU/UPV). Barakaldo, Bizkaia.
joseignacio.lopez@ehu.es
RESUMEN
Objetivos: La alteraciones de los genes reparadores de ADN llevan a la inestabilidad de microsatélites y caracterizan al adenocarcinoma familiar de colon no asociado a poliposis y al resto de tumores que se han descrito asociados a este síndrome. Asimismo, aunque se han visto alterados en un número variable de casos de cáncer esporádico, han sido muy raramente evaluados en los carcinomas de células renales. Material y métodos: Se han seleccionado 7 oncocitomas renales y 7 carcinomas renales de células cromófobas mediante criterios histológicos e inmunohistoquímicos convencionales, para el estudio de los genes reparadores de ADN mediante la expresión inmunohistoquímica de las proteínas MLH1, MSH2, y MSH6. Resultados: Existe un predominio claro del sexo masculino, tanto entre los oncocitomas (2F/5M) como entre los carcinomas (3F/4M), con edades medias de presentación de 66,8 y 63,4 años respectivamente. Entre los oncocitomas renales se ha detectado positividad para CK20 (4 casos) y CD15 (4 casos), negatividad para CK7 en todos los casos, y pérdida de la expresión proteica de MLH1 en 1 caso, de MSH2 en 2 casos, y de MSH6 en 1 caso. En los carcinomas de células cromófobas se ha observado positividad para CK7 y negatividad para CK20 y CD15 en todos los casos, y pérdida de la expresión de MSH2 en 2 casos y de MSH6 en 3. Conclusiones: El patrón de expresión de las proteínas MLH1, MSH2 y MSH6 en oncocitomas y en carcinomas renales de células cromófobas es similar, apoyando la teoría vigente de un mismo origen para ambas entidades en la nefrona distal.
Palabras clave: Oncocitoma renal, carcinoma de células cromófobas, MLH1, MSH2, MSH6.
SUMMARY
Objectives: Mismatch repair gene disorders lead to microsatellite instability and characterise the nonpolyposis hereditary colonic adenocarcinoma syndrome. Aside from that, the syndrome includes other carcinomas in different locations. Mismatch repair gene mutations have been also described in some sporadic carcinomas of diverse topographies, but only very occasionally in renal cortical carcinomas. Material and methods: Seven renal oncocytomas and 7 chromophobe cell carcinomas have been selected following conventional histological and immunohistochemical methods for the analysis of MLH1, MSH2 and MSH6 proteins. Results: There is a male predominance, both in oncocytomas and in carcinomas, with average ages of presentation of 66.8 and 63.4 years, respectively. Among the oncocytoma group, a positive immunostaining for CK20 and CD15 has been seen in 4 cases each. Loss of MLH1 expression has been detected in one case, loss of MSH2 in 2, and loss of MSH6 in one. Among the chromophobe cell carcinomas, CK7 was positive and CK20 and CD15 negative in all cases. Loss of MSH2 expression has been observed in 2 cases and loss of MSH6 in 3. Conclusions: The pattern of MLH1, MSH2 and MSH6 expression is analogous in renal oncocytomas and chromophobe cell carcinomas thus supporting the nowadays accepted theory of a similar origin in the distal nephron for both pathological entities.
Keywords: Renal oncocytoma, chromophobe cell renal cell carcinoma, MLH1, MSH2, MSH6.
INTRODUCCIÓN
Tanto el oncocitoma (OR) como el carcinoma de células cromófobas (CRCC) son, en términos relativos, dos tumores renales poco frecuentes en la práctica diaria. De hecho, la última edición de la clasificación de la OMS calcula que cada uno de ellos supone aproximadamente el 5% del conjunto de los tumores renales en adultos (1). Se trata de tumores controvertidos y relacionados, de gran complejidad diagnóstica dentro de la Anatomía Patológica actual. Son controvertidos por la existencia de gran cantidad de ejemplos «imperfectos», o «no completos», a caballo entre ambos (2,3) y por la ausencia de criterios diferenciales fiables bien definidos, lo que dificulta la labor del patólogo, obligado a menudo a refugiarse en el término evanescente de neoplasia oncocítica renal. Y son tumores relacionados porque hoy en día parece claro que tienen un origen común en la nefrona distal y porque comparten aspecto histológico y algunas alteraciones genéticas (2,4). Así, la opinión actual más compartida es que OR y CRCC son los extremos, benigno y maligno respectivamente, de un amplio espectro de lesiones oncocitarias renales que incluye múltiples situaciones intermedias, o híbridas, entre ambos (4).
Existen descritos hasta hoy 6 genes reparadores de ADN [mismatch repair (MMR) genes], relacionados entre si y con funciones complementarias, con la función de subsanar los errores post-transcripcionales del ADN en unas zonas intrónicas muy concretas del genoma denominadas microsatélites. Estos genes son hMSH2, hMSH3, hMSH6, hMLH1, hPMS1, y hPMS2 (5) y adquirieron notoriedad clínica a principios de la década de los 90 cuando, debido por lo general a mutaciones, se vieron implicados en el desarrollo de una nueva variedad hereditaria de cáncer de colon no asociado a poliposis (CCNP) (6) también llamado síndrome de Lynch (7,8). Pronto se vio que este defecto genético también predisponía al desarrollo de cánceres en otras localizaciones como estómago (9), endometrio (10), tracto urinario superior (8,11) y otros. La experiencia ha demostrado que más del 95% de las mutaciones en este síndrome ocurren en hMLH1, hMSH2 o hMSH6 (12).
Se han descrito alteraciones de alguno de estos genes en aproximadamente el 15% de los casos esporádicos de cáncer de colon (13,14) y, ocasionalmente, en otros tumores de otras localizaciones, entre ellas en neoplasias urológicas distintas de las del urotelio superior, por ejemplo, en algunos casos de carcinoma de células renales (15-18), de cáncer de próstata (19), o de cáncer de tracto urinario inferior (20).
En este trabajo se evalúa la expresión inmunohistoquímica de las proteínas relacionadas con los tres MMRs más frecuentemente implicados en el desarrollo de neoplasias, en una serie de OR y de CRCC en un intento de encontrar similitudes de expresión que refuercen la hipótesis de un origen común o diferencias que faciliten su diagnostico diferencial.
MATERIAL Y MÉTODOS
Se han utilizado para el estudio de MMRs siete ORs, seis CRCCs convencionales y un CRCC variedad eosinofílica, que han sido diagnosticados en piezas de nefrectomía en el Departamento de Anatomía Patológica. Los casos se han seleccionado retrospectivamente en el periodo 2000-2006 incluyendo ejemplos de OR de tamaños muy variables y de carcinomas de todos los grados y en todos los estadios. Antes de ser seleccionados para el estudio, cada caso ha sido reevaluado por los autores siguiendo los criterios diagnósticos al uso (1). El grado histológico se ha asignado siguiendo el sistema de Fuhrman (21) a pesar de que su utilidad haya sido puesta en cuestión recientemente (22), y el estadio según la edición de 2002 de la clasificación TNM/AJCC (23).
Las técnicas de inmunohistoquímica se han realizado mediante un método automatizado con desenmascaramiento de antígenos siguiendo las técnicas de rutina del Laboratorio. Los anticuerpos que se han utilizado son CK7 (Dako, dilución 1:50, pretratamiento con proteinasa K), CK20 (Dako, dilución 1:25) CD15 (MasterDiagnostics, dilución 1:25, pretratamiento con Tris EDTA a ph:9), MLH1 (BD PharMingen, dilución 1:100), MSH2 (Novocastra, dilución 1:100) y MSH6 (BD PharMingen, dilución 1:50). Se ha utilizado un carcinoma de colon con inestabilidad de microsatélites (IMS) demostrada, y otro estable, para control externo de la inmunotinción con MLH1, MSH2, y MSH6, y los túbulos del tejido renal adyacente al tumor como control interno. La inmunotinción se ha valorado a nivel del núcleo siguiendo una metodología previamente descrita (18). Básicamente, se ha considerado como pérdida de expresión de proteínas MLH1, MSH2, y MSH6 las inmunotinciones totalmente negativas siendo el control interno positivo. Los casos positivos se han agrupado en 3 grados dependiendo del porcentaje de positividad detectado (grado 1: <33%, grado 2: 33-66%, y grado 3: >66%).
RESULTADOS
Oncocitomas renales
Entre los ORs, se observaba un predominio del sexo masculino (2F/5M), con una edad media de 66,8 años (rango, 44-84 años). El diámetro tumoral oscilaba entre 1,7 y 9 cm (media, 5,52 cm). Macroscópicamente, los tumores presentaban el típico color marrón oscuro y el aspecto carnoso, y estaban bien delimitados pero no encapsulados. Se observaban focos hemorrágicos dispersos y cicatriz estrellada central en 3 casos. La histología mostraba un patrón de crecimiento y una celularidad típicas (fig. 1). El hierro coloidal fue negativo en todos los casos.
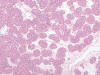
Fig. 1:
Patrón arquitectural típico del oncocitoma renal formando nidos bien definidos
de células de bordes imprecisos y citoplasmas eosinofílicos granulares en un
estroma con edema (hematoxilina-eosina, x100).
La inmunohistoquímica mostró positividad para CK20 en 4 casos (57%) (fig. 2) y positividad difusa y débil para CD15 en 3 (42,8%) (fig. 3). La CK7 resultó negativa en todos los casos. La inmunotinción nuclear con MLH1, MSH2 y MSH6 fue positiva en 6, 5, y 6 casos respectivamente (fig. 4). El porcentaje de núcleos positivos fue variable (tabla 1). La evaluación de los resultados se vio dificultada por la tinción citoplásmica de fondo, hecho que ocurre con relativa frecuencia con muchos anticuerpos en las células con alto contenido en mitocondrias (fig. 5).
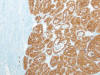
Fig. 2:
Positividad citoplásmica para CK20 en oncocitoma renal (x250).
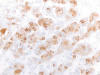
Fig. 3:
Positividad citoplásmica para CD15 en oncocitoma renal (x400).
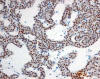
Fig. 4:
Tinción nuclear positiva con MLH1 en oncocitoma renal indicando la preservación
del gen correspondiente (x250).
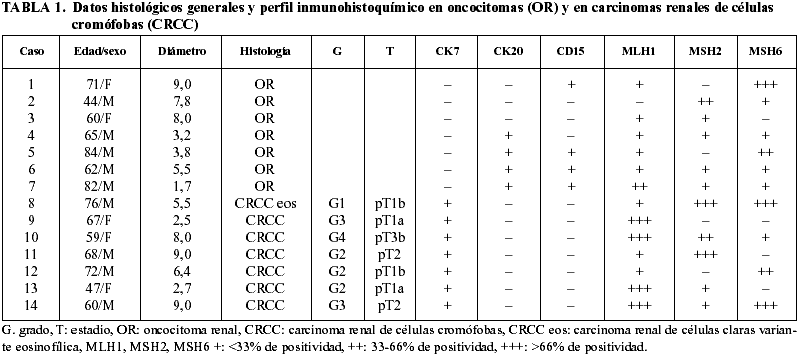
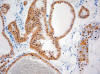
Fig. 5:
Tinción citoplásmica de fondo con MSH2 en oncocitoma renal, no valorable (x250).
Carcinomas renales de células cromófobas
Entre los CRCCs, se observaba asimismo un predominio del sexo masculino (3F/4M), siendo la edad media de 63,4 años (rango, 47-76 años). El diámetro tumoral oscilaba entre 2,5 y 9 cm (media, 4,55 cm). Microscópicamente, los tumores presentaban un color oscuro característico. Se observaba cápsula fibrosa aparente en 4 casos, siendo completa en 2 de ellos. En 2 casos se ve hemorragia extensa y en 3, fibrosis. Seis de los casos correspondían a CRCC convencionales, con nidos sólidos de células de contornos poliédricos (fig. 6), citoplasma amplio granujiento, halo claro perinuclear, y membranas nítidas (fig. 7), y uno a la variante eosinofílica, con grupos de células cuboideas intensamente eosinófilas, de menor tamaño, conservando el refuerzo nítido en la membrana citoplásmica. En la estadificación, 2 casos resultaron pT1a, 2 pT1b, 2 pT2, y 1 pT3b. Este último caso mostró extensas áreas de desdiferenciación sarcomatoide.
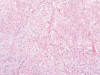
Fig. 6:
Patrón arquitectural típico del carcinoma renal de células cromófobas, mostrando
nidos sólidos y compactos de células de contorno poliédrico con límites
citoplásmicos nítidos y reforzados (hematoxilina-eosina, x100).
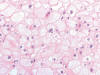
Fig. 7:
Detalle citológico del carcinoma renal de células cromófobas mostrando el
citoplasma típicamente granujiento y las membranas citoplásmicas refozadas
(hematoxilina-eosina, x400).
La inmunohistoquímica mostraba positividad intensa con CK7 (fig. 8) y negatividad con CK20 y CD15 en todos los casos. La inmunotinción nuclear con MLH1, MSH2 y MSH6 fue positiva en 7, 5, y 4 casos respectivamente (fig. 9), aunque el porcentaje de núcleos positivos fue muy variable (tabla 1). Los datos clinicopatológicos básicos y los resultados inmunohistoquímicos aparecen resumidos en la tabla 1.

Fig. 8:
Positividad citoplásmica para CK7 en carcinoma renal de células cromófobas
(x250).

Fig. 9:
Tinción nuclear positiva con MSH6 en carcinoma renal de células cromófobas
indicando la preservación de su gen correspondiente (x250).
DISCUSIÓN
Desde que Thoenes y cols. (24) describieran en 1985 el CRCC, el diagnóstico diferencial entre este tumor maligno y el OR se ha convertido en uno de los puntos más controvertidos de la práctica clínica de la Anatomía Patológica debido a trascendencia que tiene para el enfermo el etiquetar a un tumor renal como benigno o como maligno. Las dificultades se deben sobre todo al solapamiento morfológico existente entre ambos y a la ausencia de criterios diferenciales fiables. En teoría, el OR típico es un tumor que muestra un patrón arquitectural acinar o en nidos de células poligonales con núcleo central pequeño y cromático, y un citoplasma amplio eosinófilo y granular en la tinción con hematoxilina-eosina fruto del alto contenido en mitocondrias, y el CRCC un tumor que muestra un patrón de crecimiento sólido compuesto por grandes células poligonales con membranas celulares muy prominentes y citoplasma finamente reticulado fruto de la acumulación de microvesículas. La distinción entre ambos parece clara, sin embargo, en la práctica, el patólogo debe enfrentarse con relativa frecuencia con casos «a medio camino» entre ambos, en los que definirse en un sentido concreto es, cuando menos, complicado. Tradicionalmente se ha propuesto al hierro coloidal como técnica histoquímica útil en el diagnóstico diferencial, pero los resultados pueden no ser satisfactorios en todos los casos persistiendo los casos «a caballo» (3). El reconocimiento de la variante «eosinofílica» del CRCC por parte también de Thoenes y cols. (25) tres años más tarde vino a complicar aún más el estado de esta cuestión.
Los diferentes perfiles inmunohistoquímicos de ambos tumores suponen una ayuda diagnóstica adicional, existiendo mucha literatura y varios algoritmos diferenciales al respecto (4). Siguiendo a Zhou y cols (26), el panel de inmunohistoquímica más sencillo y útil para distinguir ambos tumores está compuesto por CK7, CK20 y CD15. Así, mientras el OR es negativo con CK7 y positivo con CK20 y CD15 en más del 60% de los casos, el CRCC es positivo con CK7 en 100% de los casos y invariablemente negativo con CK20 y CD15. Este patrón se ha reproducido en la serie estudiada en este trabajo, a pesar de que el marcaje con CD15 ha resultado débil y difícil de valorar.
La problemática diagnóstica se ha hecho extensiva también al área molecular. Se han descrito pérdidas complejas de cromosomas 1, 2, 6, 10, 13, 17, y 21 en el CRCC (27) y pérdidas de cromosomas 1, 14, e Y, además de traslocaciones y otras alteraciones, en el OR, pero los cambios ni son constantes, ni específicos, por lo que pierden su capacidad discriminatoria diagnóstica. Nagy y cols (27) han detectado recientemente diferencias en los microsatélites entre ambos tumores, y Brunelli y cols. (28) han observado similitudes en las pérdidas cromosómicas en el CRCC convencional y eosinofílico, pérdidas que no se dan en el OR. Estos autores sugieren que las pérdidas de cromosomas 2, 6, 10 o 17 virtualmente excluyen del diagnóstico diferencial al CRCC (28). En todo caso, la problemática de las alteraciones moleculares en estos tumores está lejos aún de ser resuelta (29) y más lejos aún de ser introducida en la rutina diaria.
Los denominados MMRs son 6 genes que se describieron en relación con un tipo determinado de adenocarcinoma de colon heredado pero no asociado a poliposis que tiene unas peculiaridades histológicas bien definidas (6). En condiciones normales, estos genes (hMSH2, hMSH3, hMSH6, hMLH1, hPMS1, y hPMS2) actúan en zonas intrónicas muy concretas y ampliamente distribuidas en el genoma denominadas microsatélites, reparando los errores que inevitablemente se producen durante los procesos de replicación del ADN. Su localización y estructura están perfectamente definidas (14). El funcionamiento incorrecto, o el no funcionamiento, de estos genes impide el reconocimiento y posterior reparación de bases mal incorporadas en el proceso de replicación, así como de inserciones anómalas o de delecciones, circunstancias que provocan la llamada IMS.
La IMS es responsable de la rápida acumulación de mutaciones somáticas en genes supresores tumorales y en oncogenes que son claves en los procesos de iniciación y progresión tumorales (30). Estudios posteriores han demostrado que estos pacientes tienen predisposición para desarrollar, además, cáncer de endometrio, ovario, intestino delgado, tracto hepato-biliar, y tracto urinario superior (31). La mayor parte de los pacientes con este síndrome muestran mutaciones en línea germinal de 3 de estos genes: hMLH1, hMSH2, o hMSH6 (12).
La demostración de mutaciones exige estudios de patología molecular sencillos pero que hoy en día están al alcance de muy pocos Laboratorios de Anatomía Patológica en nuestro país. La demostración inmunohistoquímica del perfil de expresión de las proteínas codificadas por hMLH1, hMSH2, hMSH6 y hPMS2 es una buena aproximación al problema, habida cuenta de la fiabilidad que ha demostrado esta técnica en estudios recientes (32). No obstante, en nuestra experiencia la técnica no esta exenta de problemas. Por ejemplo, el hecho de que lo valorable en una técnica inmunohistoquímica sea la ausencia de tinción, es decir, la negatividad, añade incertidumbre al proceso de interpretación, por lo que la técnica deberá hacerse con toda la garantía de controles externos e internos posibles. En el caso del oncocitoma renal se añade el problema de la tinción citoplásmica de fondo que en nuestros casos ocurre con mucha frecuencia. De esta manera, una tinción nuclear débil o moderada puede pasar desapercibida en un contexto de tinción citoplásmica no valorable. Otro problema inherente a esta tinción es que un marcaje positivo, es decir, la objetivación de que las proteínas están presentes indicando la integridad de los MMR, tiene un margen muy amplio que abarca desde menos del 33% de las células, hasta más del 66%, lo cual resulta, cuando menos, equívoco. Parece razonable utilizar la técnica inmunohistoquímica sólo como un paso rutinario previo en la identificación de tumores con posibles alteraciones en los MMR, dejando para las técnicas moleculares la identificación definitiva.
Estas alteraciones genéticas no son exclusivas del síndrome de Lynch. De hecho, se ha descrito IMS y por lo tanto, alteraciones en los MMRs, en múltiples neoplasias no heredadas, por ejemplo, se han demostrado en aproximadamente el 15% de los carcinomas de colon convencionales esporádicos (13,14). Existen trabajos que describen estas alteraciones en neoplasias de otros órganos, pero hay muy pocos que lo hagan en neoplasias corticales renales (15-18).
La primera mención a la relación entre carcinoma renal e IMS se produjo en 1996 (33), casualmente en un CRCC de una mujer de 21 años de edad. Esta circunstancia de edad de presentación tan temprana es harto infrecuente en este tumor, razón por la cual se barajó la posibilidad de una más que probable relación causa-efecto entre la alteración genética y el cáncer. No se estudiaron, en este caso, los MMR. Posteriormente se analizaron las alteraciones de estos genes en varias líneas celulares procedentes de carcinoma renal (15,16). Así, Chen y cols (15) encontraron alteraciones en el gen hMSH2 y en pol b, una ADN polimerasa necesaria para la reparación de nucleótidos, en una línea celular obtenida a partir de carcinoma de células claras, mientras que Leach y cols (16) observaron inactivación de hMLH1 en 25 líneas de cultivo diferentes de carcinoma renal.
A día de hoy, sólo existen 2 series que estudian las alteraciones de los MMR en tumores corticales renales propiamente dichos (17,18). Deguchi y cols (17) estudian 41 casos mediante RT-PCR e inmunohistoquímica. La RT-PCR encuentra en su serie una menor expresión de hMLH1 y hMSH3 en el tejido tumoral comparado con el tejido normal adyacente y una menor expresión de hMSH3 en tumores de alto grado comparado con los de bajo grado. No se observan alteraciones en el resto de los genes según estos autores (17). La inmunohistoquímica mostró una disminución significativa de la tinción nuclear con MLH1, MSH2, MSH3 y MSH6 en el tejido tumoral comparado con el normal. Por su parte, Baiyee y Banner (18) estudian recientemente la expresión inmunohistoquímica de MLH1 y MSH2 en una serie de 38 tumores corticales renales, incluyendo entre ellos cuatro CRCCs y seis ORs. Los autores describen claras diferencias en el patrón de inmunotinción entre los carcinomas derivados de la nefrona proximal (carcinoma de células claras y carcinoma papilar) y los de la distal (CRCC y OR) (18). De hecho, todos los CRCC y los OR muestran resultados positivos en el marcaje con MLH1, y todos los casos de OR, y todos menos uno de CRCC, fueron claramente positivos con MSH2. Por el contrario, entre los tumores derivados de la nefrona proximal se observan frecuentes casos negativos (18). La serie presentada en este trabajo muestra un patrón de inmunotinción de MMRs similar. No se detectan diferencias apreciables de inmunotinción entre CRCC y OR en la series de Baiyee y Banner (18) ni en la aquí presentada.
BIBLIOGRAFÍA
Lopez-Beltrán A, Scarpelli M, Montironi R, Kirkaly Z. 2004 WHO classification of the renal tumors of the adults. Eur Urol 2006; 49: 798-805.
Al-Saleem T, Cairns P, Dulaimi EA, Feder M, Testa JR, Uzzo RG. The genetics of renal oncocytosis: a possible model for neoplastic progession. Cancer Genet Cytogenet 2004; 152: 23-8.
Mai KT, Dhamanaskar P, Belanger E, Stinson WA. Hybrid chromophobe renal cell neoplasm. Pathol Res Pract 2005; 201: 385-9.
Abrahams NA, Tamboli P. Oncocytic renal neoplasms: Diagnostic considerations. Clin Lab Med 2005; 25: 317-39.
Josef J, Nyström-Lahti M. Mismatch repair defects in cancer. Curr Opin Genet Dev 2000; 10: 1069-77.
Fishel R, Lescoe MK, Rao MRS, y cols. The human mutator gene homolog MSH2 and its association with hereditary non-polyposis colon cancer. Cell 1993; 75: 1027-38.
Watson P, Lynch HT. Extracolonic cancer in hereditary nonpolyposis colorectal cancer. Cancer 1993; 71: 677-85.
Lynch HT, Ens JA, Lynch JF. The Lynch syndrome II and urologic malignancies. J Urol 1990; 143: 24-8.
Zhang Y, Liu X, Fan Y, y cols. Germline mutations and polymorphic variants in MMR, E-cadherin and MYH genes associated with familial gastric cancer in Jiangsu of China. Int J Cancer 2006; 119: 2592-6.
Stefansson I, Akslen LA, MacDonald N, y cols. Loss of hMSH2 and hMSH6 expression is frequent in sporadic endometrial carcinomas with microsatellite instability: A population-based study. Clin Cancer Res 2002; 8: 138-43.
Ericson KM, Isinger AP, Isfoss BL, Nilbert MC. Low frequency of defective mismatch repair in a population-based series of upper urothelial carcinoma. BMC Cancer 2005; 5: 23.
Peltomaki P, Vasen HF. Mutations predisposing to hereditary nonpolyposis colorectal cancer: database and results of a collaborative study. The International Collaborative Group on Hereditary Nonpolyposis Colorectal Cancer. Gastroenterology 1997; 113: 1146-58.
Fallik D, Borrini F, Boige V, y cols. Microsatellite instability is a predictive factor of the tumor response to irinotecan in patients with advanced colorectal cancer. Cancer Res 2003; 63: 5738-44.
Chaksangchaichot P, Punyarit P, Petmitr S. Novel hMSH2, hMSH6 and hMLH1 gene mutations and microsatellite instability in sporadic colorectal cancer. J Cancer Res Clin Oncol 2007; 133: 65-70.
Chen HC, Bhattacharyya N, Wang L, y cols. Defective DNA repair genes in a primary culture of human renal cell carcinoma. J Cancer Res Clin Oncol 2000; 126: 185-90.
Leach FS, Koh M, Sharma K, y cols. Mismatch repair gene mutations in renal cell carcinoma. Cancer Biol Ther 2002; 1: 530-6.
Deguchi M, Shina H, Igawa M, Kaneuchi M, Nakajima K, Dahiya R. DNA mismatch repair genes in renal cell carcinoma. J Urol 2003; 169: 2365-71.
Baiyee D, Banner B. Mismatch repair genes in renal cortical neoplasms. Hum Pathol 2006; 37: 185-9.
Leach FS, Velasco A, Hsieh JT, Sagalowsky AI, McConnell JD. The mismatch repair gene hMSH2 is mutated in the prostate cancer cell line LNCaP. J Urol 2000; 164: 1830-3.
Kassem HS, Varley JM, Hamam SM, Margison GP. Immunohistochemical analysis of expression and allelotype of mismatch repair genes (hMLH1 and hMSH2) in bladder cancer. Br J Cancer 2001; 84: 321-8.
Fuhrmann SA, Lasky LC, Limas C. Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol 1982; 6: 655-63.
Delahunt B, Sika-Paotonu D, Bethwaite PB, y cols. Fuhrman grading is not appropriate for chromophobe renal cell carcinoma. Am J Surg Pathol 2007; 31: 957-60.
Greene FL, Page DL, Fleming ID, et al, eds. AJCC Cancer Staging Handbook. TNM Classification of Malignant Tumors. New York, 2002.
Thoenes W, Störkel S, Rumpelt HJ. Human chromophobe cell renal carcinoma. Virchows Arch (B) 1985; 48: 207-17.
Thoenes W, Störkel S, Rumpelt HJ, y cols. Chromophobe renal cell carcinoma and its variants. A report on 32 cases. J Pathol 1988; 155: 277-87.
Zhou M, Roma A, Magi-Galluzzi C. The usefulness of immunohistochemical markers in the differential diagnosis of renal neoplasms. Clin Lab Med 2005; 25: 247-57.
Nagy A, Buzogany I, Kovacs G. Microsatellite allelotyping differentiates chrnophobe renal cell carcinomas from renal oncocytomas and identifies new genetic changes. Histopathology 2004; 44: 542-6.
Brunelli M, Eble JN, Zhang S, Martignoni G, Delahunt B, Cheng L. Eosinophilic and classic chromophobe renal cell carcinomas have similar frequent losses of multiple chromosomes 1, 2, 6, 10, and 17, and this pattern of genetic abnormality is not present in renal oncocytoma. Mod Pathol 2005; 18: 161-9.
Meloni-Ehrig AM. Renal cancer: Cytogenetics and molecular genetic aspects. Am J Med Genet 2002; 115: 164-72.
Kinzler KW, Vogelstein B. Lessons from hereditary colorectal cancer. Cell 1996; 87: 159-70.
Mongiat-Artus P, Miquel C, Fléjou JF y cols. Spectrum of molecular alterations in colorectal, upper urinary tract, endocervical, and renal carcinomas arising in a patient with hereditary non-polyposis colorectal cancer. Virchows Arch 2006; 449: 238-43.
Hansen TP, Nielsen O, Fenger C. Optimization of antibodies for detection of the mismatch repair proteins MLH1, MSH2, MSH6, and PMS2 using a biotin-free visualization system. Appl Immunohistochem Mol Morphol 2006; 14: 115-21.
Shuin T, Kondo K, Sakai N y cols. A case of chromophobe renal cell carcinoma associated with low chromosome number and microsatellite instability. Cancer Genet Cytogenet 1996; 86: 69-71.