
Vol. 41, n.º 3, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 3, 2008 |
CASUÍSTICA
María Teresa Fernández García, Carolina Aguilar Lizette, Manuel Florentino Fresno Forcelledo
Servicio de Anatomía Patológica del Hospital
Universitario Central de Asturias. C/. Celestino Villamil, s/n, 33006 Oviedo.
anapath1@hotmail.com
RESUMEN
Introducción: El carcinoma de células renales (CCR) tipo célula clara es un tumor maligno que puede metastatizar en múltiples localizaciones incluido el tiroides, con una baja incidencia. Presenta una citología característica que permite un rápido diagnóstico y tratamiento. Caso clínico: Presentamos el caso de una metástasis tiroidea por un CCR de células claras en un paciente de 67 años a los 12 años del diagnóstico del tumor primario en el riñón derecho.
Palabras clave: Metástasis tiroidea, CCR de células claras, Punción aspiración con aguja fina.
SUMMARY
Introduction: Clear cell type renal cell carcinoma (RCC) is a malignant tumor that can metastasize to many locations –including the thyroid–, with a low incidence. Cytological features are characteristic enough to allow a fast diagnosis and treatment. Case report: We report the case of a thyroid metastasis of clear cell RCC in a 67-year old patient, 12 years after the diagnosis of the primary tumour in right kidney.
Keywords: Thyroid metastasis, clear cell renal cell carcinoma, FNAC.
INTRODUCCIÓN
El carcinoma de células renales (CCR) de células claras (clasificación de la OMS/WHO 2004) tiene uno de los más impredecibles patrones de comportamiento dentro de los tumores malignos, metastatizando en pulmón, hígado, piel, hueso, ganglios linfáticos, cerebro y en sitios tan inusuales como cavidad nasal, encía, laringe y tiroides, pudiendo ocurrir tanto antes (lo más frecuente) como después del descubrimiento del tumor primario (1-6).
La incidencia de metástasis tiroideas por un CCR de células claras varía desde el 5 al 12% en autopsias (generalmente como hallazgo incidental) hasta el 33% en series clínicas. Para algunos autores, como Chen et al. (6) y Porcell et al. (7), el CCR de células claras es el tumor más común que metastatiza en el tiroides, llegando al 50% de los casos.
Varios autores añaden además que las metástasis ocurren con más frecuencia en lesiones neoplásicas pre-existentes, por diversas teorías aún no bien demostradas (7,8)
Su presentación clínica como nódulo tiroideo palpable es rara, siendo más frecuente un agrandamiento difuso no doloroso, revelándose en la gammagrafía como un nódulo frío.
Nuestro interés por el caso radica en la baja incidencia de las metástasis tiroideas por carcinoma de células renales en nuestro Servicio, y por extensión en la población estudiada.
CASO CLÍNICO
Paciente varón de 67 años, exfumador, ingresado en Noviembre de 2004 por proteinuria y alteración de la función renal, con palpación, durante la exploración física, de un nódulo tiroideo izquierdo sobre el que se realizan varias punciones con aspirado de un material sugestivo de cirugía (hemitiroidectomía izquierda). En el mismo ingreso, se realizan pruebas de imagen de sistema nervioso central y pulmones por disnea y alteraciones de la memoria y el comportamiento, con imagen de metástasis en base pulmonar izquierda y lesión cerebral frontal con edema acompañante.
Presenta antecedentes de nefrectomía derecha por CCR de células claras en 1993, maxilectomía superior izquierda parcial en 2001 por metástasis mucosa y ósea de un carcinoma de células claras compatible con un origen renal, y metástasis pulmonares a tratamiento quimioterápico. Lobectomía tiroidea derecha por bocio multinodular quístico hace más de 20 años.
Dada la evolución de la enfermedad junto al marcado deterioro físico del paciente, no es candidato para quimioterapia, administrándosele una única dosis de radioterapia para tratar el edema cerebral.
En el momento actual, el paciente presenta un deterioro de la función renal secundaria a la evolución de la enfermedad, así como al riñón único, y anemia secundaria a su insuficiencia renal. No se le detectan importantes alteraciones neurológicas.
CASO ANATOMOPATOLÓGICO
– PAAF: al paciente se le realizan seis punciones del nódulo tiroideo, encontrando en todas células tiroideas atípicas sueltas y abundantes placas pequeñas, a veces tridimensionales, algunas con tendencia a la configuración papilar. Los núcleos son pleomórficos con ocasionales inclusiones, y los citoplasmas claros, compatible con una «lesión proliferativa papilar con células claras atípicas, no descartándose la metástasis por un CCR de células claras» (figs. 1 y 2). No se describe presencia de vasos sanguíneos ni glóbulos hialinos intracitoplasmáticos. Se posponen estudios de histoquimia e inmunohistoquimia a material de biopsia.
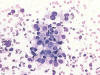
Fig. 1:
Punción aspiración con aguja fina de un grupo de células tumorales con amplios
citoplasmas claros y núcleos redondeados a ovalados, excéntricos e
hipercromáticos (Giemsa, X40).
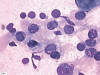
Fig. 2:
Punción aspiración con aguja fina de un grupo de células tumorales con amplios
citoplasmas claros y núcleos redondeados a ovalados, excéntricos e
hipercromáticos (Giemsa, X100).
– BIOPSIA: a nuestro servicio se remite un lóbulo tiroideo izquierdo de 3 x 2 x 1,5 cm, con un aspecto macroscópico al corte multinodular (algunos de los nódulos llegan a medir 0,3 cm de diámetro), amarillentos, de consistencia blando-elástica. La imagen histológica nos muestra múltiples grupos celulares tumorales, en los que se identifica una celularidad de citoplasma claro, membrana celular definida y núcleos pleomórficos (fig. 3). Las células son PAS positivas. Se observa además una pared vascular de tipo venoso con un émbolo tumoral que ocupa prácticamente toda la luz vascular. El diagnóstico final es de «metástasis por CCR de células claras».
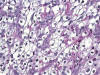
Fig. 3:
Neoformación trabecular, con septos fibrovasculares, de células con amplios
citoplasmas claros y núcleos hipercromáticos y pleomórficos
(Hematoxilina-Eosina, X40).
El estudio Inmunohistoquímico reveló una Tiroglobulina y TTF-1 negativos, y Citoqueratinas 8 y 19, EMA y CD10 positivos (figs. 4, 5 y 6).
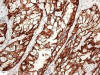
Fig. 4:
Citoqueratina 8 positiva, X40.
Fig. 6:
Tiroglobulina negativa, X40.
DISCUSIÓN
Como se mencionó al inicio de este artículo, la incidencia de metástasis tiroideas por un CCR de células claras varía desde un 33 hasta un 50%, según Chen et al. (6) y Porcell et al. (7), llegando a ser el tumor que más frecuentemente metastatiza en el tiroides, según algunos autores (7).
La citología del CCR de células claras es bastante característica, apreciando en los aspirados numerosos nidos y grupos de células con bordes definidos, abundante, claro y frecuentemente vacuolado citoplasma (en ocasiones presenta una débil granulación citoplasmática), y un núcleo grande, oval, excéntrico y moderadamente hipercromático, con nucleolo visible. La presencia de invaginaciones citoplasmáticas intranucleares no es específica de un origen renal, pudiendo corresponder también a una patología primaria tiroidea, e incluso a un melanoma (2,5). Todo ello se acompaña de un prominente patrón vascular (8,9).
El aspecto claro del citoplasma de dichas células puede ser debida al escaso contenido en organelas junto a la acumulación de glucógeno, tiroglobulina, grasa, mucina y, a veces, combinaciones de las mismas (1).
Todos estos datos son el origen de nuestras sospechas de metástasis tiroidea por un tumor primario renal (4), proporcionándonos una base para un rápido diagnóstico (1,2).
Uniendo los datos clínicos junto a la citomorfología, histoquimia, inmunohistoquimia y biología molecular, el diagnóstico diferencial de tumores de células claras de localización tiroidea, incluye (4,5,9):
1. Lesiones primarias tiroideas:
a) Los tumores de células claras tiroideos son subtipos de las principales neoplasias tiroideas, siendo más frecuente la variante del carcinoma folicular, y raras veces del medular (7).
b) Las células claras también pueden verse en lesiones benignas como bocio, enfermedad de Graves, tiroiditis de Hashimoto o adenomas foliculares, sin embargo, son mucho mas frecuentes en patología tiroidea maligna.
También las células de Hürthle son candidatas a presentar esta imagen debido a la dilatación de sus mitocondrias (1).
En algunas ocasiones, los histiocitos pueden simular células del CCR, por lo que autores como Zajicek son partidarios de que el diagnóstico se haga sobre grupos celulares, y no en células sueltas que se prestan a confusión con los histiocitos. Sin embargo, en los casos en que dichas células aisladas presenten núcleo atípico y excéntrico, con abundante citoplasma que nos plantee un fuerte diagnóstico diferencial con el carcinoma, debemos prestar atención a la textura y contenido del citoplasma, siendo más uniformemente claro en éste último (9).
2. Metástasis de un carcinoma de células claras con origen en (1,2,7,11):
a) Riñón.
b) Glándula salival (de tipo acinar).
c) Pulmón.
d) Ovario.
e) Glándula paratiroides.
f) Otros. Aunque su frecuencia sea muy pequeña, debe hacerse un diagnóstico diferencial con el melanoma, particularmente si hay inclusiones intranucleares. El carcinoma adrenal cortical también debería ser considerado.
De todas las patologías enumeradas anteriormente, el principal diagnóstico diferencial es con el CCR de células claras, lo que puede ser difícil, citológicamente hablando. Para ello nos ayudamos de:
– Técnicas histoquímicas: tinciones para lípidos neutros (oil red O) y glucógeno (PAS), son usualmente positivas (PAS positivo, no diastasa resistente) en el CCR de células claras, y negativos en las neoplasias de origen tiroideo. Por otra parte, los tumores malignos de células claras primarios tiroideos pueden presentar inclusiones intracitoplasmáticas azul alcián y mucicarmín positivos, al contrario que el CCR de células claras (7).
– Técnicas inmunohistoquímicas, que juegan un papel fundamental. La Tiroglobulina junto con el TTF1 (Factor de Transcripción Tiroideo) nos permite hacer el diagnóstico diferencial entre un origen tiroideo (Tiroglobulina y TTF1 positivos) y renal (Tiroglobulina y TTF1 negativos). Además el anticuerpo CD10 es muy positivo en el carcinoma renal, así como la Citoqueratina 8 (13).
Con la positividad para EMA se descartan carcinomas de la corteza suprarrenal, melanomas y la mayoría de tumores de células germinales y tumores de los cordones sexuales/estroma. Si bien la positividad de la Citoqueratina 19 es más orientativa de carcinomas papilares de origen tiroideo, puede ser positiva en el CCR de células claras (13).
– La alteración molecular más característica del CCR de células claras (o más correctamente de todos los subtipos de CCR no papilares, excluyendo el oncocítico), es una delección en el brazo corto del cromosoma 3, 3p13. También podemos encontrar: sobreexpresión de p53 de un 10 a un 35% de los casos, pérdida de la expresión del gen Rb en el 20% de los casos y del Fhit en alrededor del 90% (siendo esta última específica del subtipo célula clara) (13).
En nuestro caso, la historia previa de un CCR de células claras, junto a la citología y la histología, ayudado por técnicas especiales (nuestro tumor es PAS positivo) y la inmunohistoquímica (Tiroglobulina y TTF-1 negativo, Citoqueratinas 8 y 19, EMA y CD10 positivos), nos llevaron al diagnóstico final de «metástasis tiroidea compatible con primario renal», confirmando el diagnóstico citológico inicial (tabla 1) (11).

El tratamiento de tales lesiones suele ser quirúrgico, con buen pronóstico (ocasionalmente curativo) en los casos que la lesión sea única, sin metástasis en otras localizaciones (4,6-8).
CONCLUSIÓN
Debemos considerar la posibilidad de una metástasis tiroidea por un CCR de células claras, en los casos de una punción-aspiración de un nódulo tiroideo positivo para malignidad y amplios citoplasmas claros, ya que aunque globalmente la probabilidad que el tumor tiroideo sea secundario es muy baja, dentro de las metástasis el primario renal es de los más frecuentes, sobre todo si tienen historia previa de primario renal.
Uniendo la clínica y la información aportada por el aspirado, podemos llegar a un diagnóstico citológico que sea capaz de orientar hacia una actitud quirúrgica de las lesiones tiroideas, confirmándose posteriormente con la biopsia unido a técnicas inmunohistoquímicas.
Todo ello es de suma importancia en el caso de la patología tumoral tiroidea, dado el buen pronóstico en lesiones diagnosticadas a tiempo y sugestivas de ser tratadas quirúrgicamente.
BIBLIOGRAFÍA
Linsk J, Franzén S. Aspiration cytology of metastatic hypernephroma. Acta Cytol 1984; 28: 250-9.
Lasser A, Rothman J, Calamia V. Renal-cell carcinoma metastatic to the thyroid. Aspiration cytology and histologic findings. Acta Cytol 1985; 29: 856-8.
Jayaram G. Cytology of clear cell carcinoma of the thyroid [letter]. Acta Cytol 1989; 33: 135-6.
Green LK, Ro JY, Mackay B, Ayala AG. Luna MA. Renal cell carcinoma metastatic to the thyroid. Cancer 1989; 63: 1810-5.
Halbauer M, Kardum-Skelin I, Vranesic, Crepinko I. Aspiration cytology of renal-cell carcinoma metastatic to the thyroid. Acta Cytol 1991; 35: 443-6.
Chen H, Nicol TL, Udelsman R. Clinically significant, isolated metastatic disease to the thyroid gland. World Journal of Surgery 1999; 23: 177-81.
Porcell AI, Hitchcock CL, Keyhani-Rofagha S. Use of immunohistochemistry in fine needle aspiration of thyroid nodules in patients with a history of malignancy. Acta Cytol 2000; 44: 393-8.
Koo HL, Jang J, Hong SJ, Shong Y, Gong G. Renal cell carcinoma metastatic to follicular adenoma of the thyroid gland. A case report. Acta Cytol 2004; 48: 64-8.
Hughes JH, Jensen CS, Donnelly AD, Cohen MB, Silverman JF, Geisinger KR, et al. The role of fine needle aspiration cytology in the evaluation of metastatic clear cell tumors. Cancer 1999; 87: 380-9.
Chaco MS, Greenebaum E, Moussouris HF, Schreiber K, Koss LG. Value of aspiration cytology of the thyroid in metastatic disease. Acta Cytol 1987; 31: 705-12.
Domagala W, Lasota J, Wolska H, Lubinski J, Weber K, Osborn M. Diagnosis of metastatic renal cell and thyroid carcinomas by intermediate filament typing and cytology of tumor cells in fine needle aspirates. Acta Cytol 1988; 32: 415-21.
Sunita, Kapila K, Singhal RM, Verma K. Fine needle aspiration diagnosis of an unusual presentation of metastatic renal cell carcinoma [letter to the editor]. Acta Cytol 1991; 35: 260-1.
Ordóñez NG, Rosai J. Urinary tract. En: Rosai J. Rosai and Ackerman´s Surgical Pathology. Ninth edition. Vol I. Philadelphia: Mosby; 2004. p. 1256.
Renshaw AA, Lee KR, Madge R, Granter SR. Accuracy of fine needle aspiration in distinguishing subtypes of renal cell carcinoma. Acta Cytol 1997; 41: 987-93.