
Vol. 41, n.º 3, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 3, 2008 |
ORIGINALES
Francisco Javier Torres Gómez1, Luis Felipe Calle Cruz2, Francisco Javier Torres Olivera3
1 Hospital de Alta
Resolución de Utrera. Avda. Brigadas Internacionales, s/n, 41710 Utrera,
Sevilla.
2 Unidad de Anatomía
Patológica. Departamento de Citología e Histología Normal y Patológica. Facultad
de Medicina de Sevilla.
3 Hospital Virgen
Macarena de Sevilla. Departamento de Anatomía Patológica.
javiertorresgomez@yahoo.es
RESUMEN
Antecedentes: Los resultados obtenidos al correlacionar los valores cariométricos con el estatus ganglionar y con la expresión inmunohistoquímica son discrepantes en la literatura. Métodos: Con el propósito de aclarar esta relación se han medido el área, perímetro, diámetro y factor de forma medios nucleares en 100 células neoplásicas obtenidas por PAAF en cada uno de 366 casos de carcinoma ductal infiltrante mamario. Asimismo se han correlacionado dichos valores con la expresión inmunohistoquímica (receptores estrogénicos, p53, c-erb-B2 y Ki-67) en 349 casos. Resultados y conclusiones: Los resultados obtenidos indican adecuada correlación entre la expresión inmunohistoquímica y la morfometría, salvo con el factor de forma, pero no con el estatus ganglionar axilar y el número de ganglios afectados.
Palabras clave: PAAF, morfometría, estatus ganglionar, carcinoma de mama.
SUMMARY
Background: The results obtained from the correlation between karyometric value, lymph node status and immunohistochemical expression are variegated in literature. Methods: In order to clarify this question, the mean nuclear area, perimeter and form factor have been measured in 100 neoplastic cells obtained by FNA in every case of 366 invasive ductal carcinoma of the breast. We have also made the correlation between these parameters and immunohistochemical expression for oestrogen receptors, p53, c-erb-B2 and Ki-67 in 349 cases. Results and conclusions: The results obtained indicate good correlation between immunohistochemical expression and morphometry -with the exception of form factor-, but not, however, with lymph node status and number of affected nodes.
Keywords: FNAC, morphometry, lymph node status, breast carcinoma.
INTRODUCCIÓN
La correlación establecida entre los diferentes parámetros morfométricos nucleares y los factores con valor pronóstico consensuado en el cáncer mamario (tamaño tumoral, grado histológico, estatus ganglionar axilar y positividad para receptores estrogénicos) presenta grandes discrepancias (1-21). Los factores de forma (esfericidad y elipsoidicidad) también presentan discrepancias en cuanto a su valor pronóstico (6,20,22,23). Los parámetros morfométricos nucleares han discriminado entre lesiones benignas y malignas (5,24,25), se han correlacionado significativamente con los patrones de DNA y con el grado convencional en una amplia variedad de tumores (22,26) y en el caso del cáncer mamario, con la supervivencia y riesgo de metástasis (4,6,12,16,18,19). En un trabajo anterior (27) hemos obtenido diferencias significativas entre los valores morfométricos nucleares obtenidos en células mamarias normales y las neoplásicas y correlación estadísticamente significativa entre dichos valores y los Grados Citológico e Histológico, excepto con el factor de forma. Los resultados dispares obtenidos en la correlación entre el estatus ganglionar y la expresión inmunohistoquímica y los valores morfométricos cariométricos reflejados en la literatura nos han motivado a obtener nuestras propias conclusiones.
MATERIAL Y MÉTODOS
Se han valorado morfométricamente el área, perímetro, diámetro máximo y factor de forma medios nucleares en 100 células neoplásicas por caso, obtenidas por PAAF de las piezas de tumorectomías remitidas sin fijar para estudio intraoperatorio en 366 casos de carcinoma ductal infiltrante. Las extensiones citológicas se han teñido según el método de Papanicolaou convencional. La captación de imagen se ha realizado a 400 x en un microscopio Olympus BX40 y el análisis digital en un Morfómetro Kontron Messgeraete GMBH de forma automática. El estudio se ha realizado con entrenamiento previo y desconociendo el resultado del informe anatomopatológico. Asimismo, dichos parámetros cariométricos se ha correlacionado con la expresión inmunohistoquímica de receptores estrogénicos, p53, c-erb-B2 y Ki-67 en 349 casos.
RESULTADOS
1. Correlación entre EG y parámetros morfométricos (Am, Pm, Dm y Fm)
En los 189 casos con ganglios negativos se obtuvo un área nuclear media (Am) de 1744,61 µm2, un perímetro nuclear medio (Pm) de 1482,67 µm, un diámetro nuclear máximo medio (Dm) de 470,89 µm y un factor de forma medio (Fm) de 92,55%.
En los 177 casos con ganglios metastásicos se obtuvo un Am de 1775,48, un Pm de 1511,66, un Dm de 476,49 y un Fm de 92,68.
En los 84 casos con 3 o menos ganglios afectados se obtuvo un Am de 1807,44, un Pm de 1520,09, un Dm de 480,92 y un Fm de 92,6.
En los 93 casos con más de 3 ganglios afectados se obtuvo un Am de 1743,52, un Pm de 1503,24, un Dm de 472,06 y un Fm de 92,76.
Estos resultados quedan reflejados en la tabla 1.

2. Correlación entre valores morfométricos y expresión inmunohistoquímica
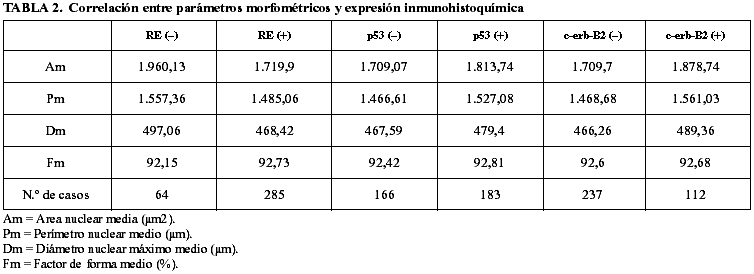
En los 285 casos que expresaron RE se obtuvo un Am de 1719,90 con un rango entre 598,70 y 4375,10, un Pm de 1485,06 con un rango entre 890,80 y 2756,60, un Dm de 468,42 con un rango entre 258,80 y 763,60 y un Fm de 92,73 con un rango entre 88,80 y 95.
En los 64 casos que no expresaron RE se obtuvo un Am de 1960,13 con un rango entre 440,80 y 5709,30, un Pm de 1557,36 con un rango entre 767,70 y 2724,30, un Dm de 497,06 con un rango entre 245 y 850,40 y un Fm 92,15 con un rango entre 64,70 y 94,80.
En los 183 casos que expresaron p53 se obtuvo un Am de 1813,74 con un rango entre 598,70 y 3227,70, un Pm de 1527,08 con un rango entre 912,90 y 2756,60, un Dm de 479,40 con un rango entre 258,80 y 649 y un Fm de 92,81 con un rango entre 89,10 y 94,90.
En los 166 casos que no expresaron p53 se obtuvo un Am de 1709,07 con un rango ente 440,80 y 5709,30, un Pm de 1466,61 con un rango entre 767,70 y 2724,30, un Dm de 467,59 con un rango entre 245 y 859,40 y un Fm de 92,42 con un rango entre 64,70 y 95.
En los 112 casos con expresión positiva de c-erb-B2 se obtuvo un Am de 1878,74 con un rango entre 778,30 y 4375,10, un Pm de 1561,03 con un rango entre 1010,40 y 2756,60, un Dm 489,36 con un rango entre 258,80 y 763,80 y Fm de 92,68 con un rango entre 89,10 y 94,80.
En los 237 casos sin expresión de c-erb-B2 se obtuvo un Am de 1709,70 con un rango entre 440,80 y 5709,30, un Pm de 1468,68 con un rango entre 767,70 y 2724,30, un Dm de 466,26 con un rango entre 245 y 850,40 y un Fm de 92,60 con un rango entre 64,70 y 95.
Estos resultados quedan reflejados en la tabla 2.
DISCUSIÓN
El estatus ganglionar axilar es un dato objetivo y uno de los factores pronósticos independientes más importante en las pacientes con cáncer de mama (28,29). La supervivencia a los 5 años de pacientes sin metástasis ganglionar axilar comprobada histológicamente es del 67-85%. Esta tasa declina progresivamente con el número de ganglios afectados a partir de cuatro (30,31), aproximándose al 30% cuando están metastatizados 10 ganglios axilares. Mientras la tasa de mortalidad es del 25-30% en las pacientes con carcinoma limitado a la mama sin metástasis ganglionares, esta tasa se eleva al 50-75% en las que el tumor se acompaña de ganglios axilares afectados (32,33). Sin embargo se han obtenido tasas de supervivencia similares en ambos grupos (12).
Hemos obtenido adecuada correlación entre el GH y el EG (27).
Diferentes parámetros nucleares determinados morfométricamente en carcinomas de mama muestran correlación significativa con el grado histológico (34-36) y muestran valor predictivo de metástasis axilar en el momento de la intervención quirúrgica (36). La anisocariosis (desviación típica del radio nuclear) ha sido el parámetro morfométrico con mayor valor predictivo del curso clínico de la enfermedad en pacientes sin afectación ganglionar axilar (37). Los parámetros morfométricos dimensionales nucleares (área, perímetro, diámetro máximo y factor de forma) han mostrado su valor discriminante entre los casos sin y con metástasis ganglionares axilares en los tumores menores de 2 cm. Este valor discriminante se pierde cuando el tumor supera dicho diámetro (20). El área nuclear, el diámetro nuclear y sobre todo el diámetro menor nuclear medio permiten evaluar el curso favorable, intermedio o desfavorable del cancer mamario (18). El área nuclear se ha correlacionado con el tamaño tumoral, pero no con el estatus ganglionar axilar (16) ni con el grado histológico (17). Otros autores encuentran correlación significativa entre área nuclear, grado histológico y ploidia (1,2,5). La desviación típica del perímetro nuclear tiene un valor predictivo independiente en los casos sin afectación ganglionar axilar (35,36). El pleomorfismo nuclear que refleja las asimetrías de forma y las irregularidades del contorno nuclear discriminan significativamente los casos con ganglios axilares positivos y negativos (38). para algunos autores los factores de forma son demasiados sensibles a la resolución (que modifica el perímetro) y proporcionan valores similares para formas o perímetros muy diferentes por lo que no son útiles como datos objetivos (22). Para otros, los factores de elipsoidicidad y de esfericidad tienen un importante valor pronóstico (13,14,16,23) y la irregularidad nuclear valor determinante entre lesiones benignas y malignas (20,24). Los parámetros morfométricos nucleares han probado su utilidad en la diferenciación de lesiones benignas y malignas (5,24,25,39,40), se han correlacionado significativamente con los patrones de DNA y con el grado convencional en una amplia variedad de tumores (22,26) y en el caso del cáncer mamario, con el grado histológico, tamaño tumoral, receptores hormonales, supervivencia y riesgo de metástasis (6,16,18). La aplicación de morfometría ha resultado útil para discriminar los casos con buena o mala respuesta al tratamiento quimioterápico adjuvante (41).
Hemos encontrado diferencias estadísticamente significativas entre los valores morfométricos obtenidos en el grupo testigo y los obtenidos en los grupos de pacientes con carcinoma ductal infiltrante con distinto GH (5). Los valores morfométricos se incrementan progresivamente en relación directa al aumento del GH en todos los parámetros morfométricos considerados (área nuclear media, perímetro nuclear medio y diámetro nuclear máximo medio). Estos resultados son coincidentes con los de algunos autores (1,2,6,18,20) y discordantes con otros (17). Únicamente el factor de forma medio ha experimentado pequeñas fluctuaciones no correlacionadas con el GH, sin alcanzar en ningún caso la esfericidad, por lo que parece que el núcleo de la célula tumoral del carcinoma ductal infiltrante conserva de forma constante su forma ovoide (42). Para algunos autores la aproximación a la esfericidad conlleva mal pronóstico (16).
No se han obtenido diferencias estadísticamente significativas al correlacionar los valores numéricos de los diferentes parámetros morfométricos con el EG. Estos resultados coinciden con los de otros trabajos (17).
La determinación inmunohistoquímica de receptores hormonales en las células tumorales mamarias es un método valorativo del grado de diferenciación tumoral (16,43-47) útil desde el punto de vista terapéutico, ya que las pacientes que los expresan responden mejor al tratamiento con Tamoxifeno u otras formas de modulación hormonal que las que no los expresan (48-55). Se ha relacionado la expresión de receptores estrogénicos con un crecimiento lento del tumor (27,29) y su diferente expresión en relación a los distintos grados histológicos combinados (16,56-59).
El factor de proliferación celular (Ki-67) se correlaciona con el índice mitósico (60).
La sobreexpresión y/o amplificación del protooncogen HER-2, implicado en la regulación de los receptores de los factores de crecimiento, se manifiesta inmunohistoquímicamente por la sobreexpresión de la proteína c-erb-B2 (neu). El método inmunohistoquímico es muy específico cuando es negativo o cuando es fuertemente positivo, relacionándose en este caso con alto grado histológico, baja supervivencia y mala respuesta al tratamiento hormonal y quimioterápico convencional (61). Asimismo, la sobreexpresión de c-erb-B2 posibilita el bloqueo del dominio extracelular del receptor de membrana con Transtuzumab con efecto terapéutico beneficioso en pacientes con carcinoma mamario metastásico (62). Los casos de positividad intermedia necesitan de una valoración con hibridación fluorescente in situ (FISH) antes de aplicar la terapéutica (63).
La sobreexpresión de p53 se produce en el 25% de los carcinomas mamarios debido a la mutación del gen supresor TP53, lo que provoca una acumulación de proteína inactiva y estable en las células tumorales. No obstante, en el 20% de los casos, la mutación no produce proteína estable, que no es detectada por el método inmunohistoquímico, por lo que la sobreexpresión de p53 ocurre en prácticamente el 50% de los casos (64). La participación de p53 en procesos tan importantes como el control del ciclo celular, reparación del ADN y apoptosis sugiere que la mutación en diferentes localizaciones del gen condiciona un pronóstico más o menos favorable (65-67).
La expresión inmunohistoquímica de RE, p53 y c-erb-B2 se correlaciona significativamente con los valores numéricos obtenidos al evaluar los diferentes parámetros morfométricos, obteniéndose valores numéricos más elevados en los grupos de casos con RE negativos, y en los que expresan p53 y c-erb-B2, con diferencias significativas con respecto a sus grupos antagonistas respectivos.
BIBLIOGRAFÍA
Klorin G, Keren R. Ploidy and nuclear area as a predictive factor of histologic grade in primary breast cancer. Analyt Quant Cytol Histol 2003; 25: 277-80.
Klorin G, Keren R. Pronostic markers in cytologic specimen of breast cancer. Analyt Quant Cytol Histol 2003; 25: 297-302.
Thalan A, Nijhawan R, Joshi K. Gradin of ductal breast carcinoma by cytomorphometry and image morphometry with histologic correlation. Analyt Quant Cytol Histol 2000; 22: 193-8.
Wolberg WH, Street WN, Heisey DM, et al. Computer-derived nuclear «grade» and breast cancer prognosis. Anal Quant Cytol Histol 1995; 17: 257-64.
Elazagheid A, Collan Y. Fine needle aspiration biopsy of the breast. Value of nuclear morphometry after different sampling methods. Anal Quant Cytol Histol 2003; 25: 73-80.
Maehle BO, Thoresen S, Skjaerven R, et al. Mean nuclear area and histological grade of axillary-node tumour in breast cancer, related to prognosis. Br J Cancer 198; 46: 95-100.
Pienta K, Coffey DS. Correlation of nuclear morphometry with progression of breast cancer. Cancer 1991; 68: 2012-6.
Van Diest PJ, Matze-Cok E, Baak JP. Prognostic value of proliferative activity in lymph node metastases of patients with breast cancer. J Clin Pathol 1991; 44: 416-8.
Van Diest PJ, Baak JP. The morphometric prognostic index is the strongest prognosticator in premenopausal lymph node-negative and lymph node-positive breast cancer patients. Hum Pathol 1991; 22: 326-30.
Zajdela A, de Maublanc MA. Value and interest of fine needle aspiration cytology in the follow-up of irradiated breast cancers (author's transl). Bull Cancer 1979; 66: 107-12.
Baak JP, Kurver PH, De Snoo-Niewlaat AJ, et al. Prognostic indicators in breast cancer–morphometric methods. Histopathology 1982; 6: 327-39.
Baak JP, Van Dop H, Kurver PH, et al. The value of morphometry to classic prognosticators in breast cancer. Cancer 1985; 56: 374-82.
Van Bogaert LJ, de Muylder C, Maldague P, et al. Prognostic implications of mean nuclear diameter in breast cancer. Br J Cancer 1980; 42: 537-41.
Van Bogaert LJ, de Muylder C. Nuclear diameters of breast cancer cells in tissue sections. Anal Quant Cytol 1980; 2: 55-8.
Wittekind C, Schulte E. Computerized morphometric image analysis of cytologic nuclear parameters in breast cancer. Anal Quant Cytol Histol 1987; 9: 480-4.
Van der Linden H, Baak J, Lindeman y cols.: Morphometry and Breast Cancer II. Characteristation of breast cancer cells with high malignant potencial in patients with spread to lymph nodes: Preliminary results. J Clin Pathol 1986; 39: 603-9.
Sarker S. Mean nuclear area of fine needle aspiration of primary preoperative palpable breast carcinoma using image cytometry. Analyt Quant Cytol Histol 2002; 24: 85-8.
Kronqvist P, Kuopio T, Collan Y. Morphometric grading of invasive ductal breast cancer: I. Thresholds for nuclear grade. Br J Cancer 1998; 78: 800-5.
Tuczek HV, Fritz P, Schwarzmann P, et al Breast carcinoma. Correlations between visual diagnostic criteria for histologic grading and features of image analysis. Anal Quant Cytol Histol 1996; 18: 481-93.
Giardina C, Ricco R, Serio G, et al. Means shape and axillary metastases in breast cancer. Analytic morphometry of aspiration smears. Acta Cytol 1994; 38: 341-6.
Wolberg WH, Street WN: Computer-generated nuclear features compared with axillary lymph node status and tumor size as indicators of breast cancer survival. Hum Pathol. 2002; 33:1086-91.
Rigaut J. Kariometry on sections from dysplastic and cancerous tissues. En: J Mary J Rigaut editors. Quantitative Image Analysis in Cancer Cytology and Histology. New York, NY: Elselvier Science; 1986.
Antúnez–Potashkina I, Coro-Antich R, Rodriguez Ceballos S. Morfometría computerizada en aspirados celulares del carcinoma ductal infiltrante de la mama. Modelo de estadística multivariada. Rev Esp Patol 1997; 30: 193-9.
Boon M, Trott P, Van Kaam H, et al. Morphometry and cytodiagnosis of breast lesions. Virchow Arch 1982; 396: 9-18.
Norris HJ, Bahr GF, Mikel UV. A comparative morphometric and cytophotometric study of intraductal hyperplasia and intraductal carcinoma of the breast. Anal Quant Cytol Histol 1988; 10: 1-9.
Buhmeida A, Kuopio T , Collan Y. Nuclear size and shape in fine needle aspiration biopsy samples of the prostate. Analyt Quant Cytol Histol 2000; 22: 291-8.
Torres Gómez, FJ, Calle Cruz LF, Torres Olivera FJ. Correlación entre la valoración subjetiva de parámetros nucleares en la PAAF, del grado citológico y del grado histológico, y la morfometría en el carcinoma ductal infiltrante mamario. Rev Esp Patol. En prensa.
Miralles T, Buesa J, editores. Punción-aspiración con aguja fina. Madrid: Salvat Editores; 1988.
Ellis I, Schmitt S, Sastre-Garau X, et al. Invasive breast carcinoma. En: Tavassoli F & Devilee P editores. Pathology and Genetics of Tumours of the Breast and Female Genital Organs. Lyon: WHO. IARC Press; 2003. p. 13-59.
Zajdela A, Pilleron JP, Ennuyer A, et al. Cytological examination. Solid breast tumors examined by means of fine-needle puncture. J Gynecol Obstet Biol Reprod (Paris). 1975; 4: 59-66.
Fitzgibbons P, Page D, Weaver D, et al. Prognostic Factors in Breast Cancer.College of American Pathologists Concensus Statement 1999. Arch Pathol Lab Med 2000: 124; 966-78.
Vioque J, Ferrer PJ, Bolumar F. Income, percent of women living in rural areas, parity, and breast cancer mortality in Spain (1971-1991). Med Clin 1997; 108: 41-4.
Arora R, Joshi K, Nijhawan R, et al. Angiogenesis as an independent prognostic indicator in node-negative breast cancer. Analyt Quant Cytol Histol 2002; 24: 228-33.
Aaltomaa S, Lipponnen P, Papinaho S, et al. Nuclear morphometry and DNA flow cytometry as prognostic factors in female breast cancer. Eur J Surg 1992; 158: 135-41.
Aaltomaa S, Lipponnen P, Eskelinen M, et al Tumor size, nuclear morphometry, mitotic index as prognostic factors in axilary lymph node positive breast cancer. Eur J Surg 1992; 24: 160-8.
Aaltomaa S, Lipponnen P, Eskelinen M, et al. Nulcear morphometry and mitotic indexes as prognostic factors in breast cancer. Eur J Surg 1991; 157: 319-24.
Aubele M, Auer G, Hofler H. Analysis of DNA and morphometry in breast carcinoma. Histochem Cell Biol 1996; 106: 241-5.
Giardina C, Renzulli G, Serio G, et al. Nuclear morphometry in node–negative breast carcinoma. Anal Quant Cytol Histol 1996; 18: 374-82.
Cornelisse C, De Koning H, Arentz P, et al. Quantitative analysis of variation in benign and malignant breast cytology specimens. Analyt Quant Cytol 1981; 3: 128-34.
Lindholm J, Van Diest P, Haffner D, et al. A morphometric filter improve the diagnostic value of morphometric analyses of frozen histological sections from mammary tumours. Anal Cell Pathol 1992; 4: 443-9.
Van Diest P, Baak J, Matze, et al. Prediction of response to adjuvant chemotherapy in premenopausal lymph node positive breast cancer patients with morphometry, DNA flow cytometry and HER-2/n eu oncoprotein expresion. Pathol Res Pract 1992; 188: 344-9.
Martinez-Giron R, García-Miralles MT, Sampedro-Nuño A. Grado nuclear en punciones de carcinoma de mama: características ópticas y análisis de imagen. Rev Esp Patol 2000: 32; 139-45.
Zajicek J, Caspersson T, Jakopbsson P, et al. Cytologic diagnosis of mammary tumours from aspiration biopsy smears. Acta Cytol 1970; 14: 370.
Hunt C, Ellis F, Elston C, et al. Cytological grading of breast carcinoma a feasible proposition?. Cytology 1992; 3: 61.
Fisher B, Costantino J, Redmond C. A randomized clinical trial evaluating Tamoxifen in the treatment of patients with node-negative breast cancer who have estrogen-receptor-positive tumors. N Engl J Med 1989; 320: 479-84.
Henderson I, Canellos. Cancer of the breast. The past decade. N Engl J Med 1980; 103: 17-20.
McGuire W, Tandon A, Allred D, et al. How to use prognostic factors in axillary node-negative breast cancer patients. J Natl Cancer Inst 1990; 82: 1006-15.
Oliva J, Lobo F, Lopez-Bastida J, et al. Indirect cost of cervical and breast cancer in Spain. Eur J Health Econ 2005; 6: 309-13.
Robinson I, McKee G. Cytologic grading of breast carcinoma. Acta Cytol 1995; 39: 1257.
Thor A. Pronostic factors in breast cancer: Integrating the cytology laboratory. Diag Cytopathol 1992; 8: 319-21.
Zoppi J, Rotundo A, Sundbland A: Correlation of immunocytochemical and inmunohistochemical determination of estrogen and progesterone receptors in breast cancer. Acta Cytol 2002; 46: 337-340.
Zoppi J, Pellicer E, Sundbland A. Cytohistologic correlation of nuclear grade in breast carcinoma. Acta Cytol 1997; 41: 701-4.
Weidner N, Mooore D, Vartanian R. Correlation of Ki-67 antigen expression with mitotic figure index and tumor grade in breast carcinomas using the novel paraffin reactive M1B1 antibody. Human Pathol 1994; 25: 337-42.
Anderson E. The use of steroid receptors in predicting response to hormonal therapy. En: Walter R. editor. Prognostic and Predictive Factors in Breast Cancer. London: Martin Dunits; 2003. p. 135-46.
Harvey J, Clark G, Osborne C, et al. Estrogen receptor status by immunohistochemistry is superior to the ligand-binding assay for predicting response to adjuvant endocrine therapy in breast cancer. J Clin Oncol 1999; 17: 1474-81.
Hunt C, Ellis F, Elston C, et al. Cytological grading of breast carcinoma a feasible proposition? Cytology 1992; 3: 61.
Visscher D, Sarkar F, Crissman J. Clinical significance of pathologic, cytometric and molecular parameters in carcinoma of the breast. Advances Pathol Lab Med: 1992; 5: 123-61.
Anderson I, Canellos. Cancer of the breast. The past decade. N Engl J Med 1980; 103: 17-20.
McGuire W, Tandon A, Allred D, et al. How to use prognostic factors in axillary node-negative breast cancer patients. J Natl Cancer Inst 1990; 82: 1006-15.
Connor A, Pinder S, Elston C, et al. Intratumoral hetereogeneity of proliferation in invasive breast carcinoma evaluated with MIB-1 antibody. Breast 1997; 6: 171-6.
Thor A, Berry D, Budman D, et al. Erb-2, p53, and efficacy of adjuvant therapy in lymph node-positive breast cancer. J Natl Cancer Inst 1998; 90: 1346-60.
Vogel C, Cobleigh M, Tripathy D, et al. Efficacy and safety of Trastuzumab as a single agent in first-line treatment of Her-2 overexpressing metastatic breast cancer. J Clin Oncol 2002; 20: 719-26.
Ridolfi R, Jamenhdor M, Arber J. Her-2/neu testing in breast carcinoma: a combined immunohistochemical and fluorescence in situ hibridation approach. Mod Pathol 2000; 13, 866-73.
Erden O, Dursun A, Loskun U, et al. The prognostic value of p53 and c-erb-B2 expression, proliferative activity and angiogenesis in node-negative breast carcinoma. Tumori 2005; 91: 46-52.
Kucera E, Speiser P, Gnant M, et al. Prognostic significance of mutation in the p53 gene, particularly in the zinc-binding domains, in lymph node-and steroid receptor positive breast cancer patient. Austrian Breast Cancer Study Group. Eur J Cancer 1999; 35: 398-405.
Zheng W, Zhan R. Quantitative comparison of apoptosis to cell proliferation and p53 protein in breast carcinomas. Analyt Quant Cytol Histol 1998; 20: 1-6.
Wood D, Vousden K. Regulation of p53 function. Exp Cell Res 2001; 264: 56-66.