
Vol. 41, n.º 2, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 2, 2008 |
CASUÍSTICA
Juan Segura Sánchez, Eduardo Solís García, Teresa González Serrano
Servicio de Anatomía Patológica. Hospital Infanta
Margarita. Cabra (Córdoba)
jsegurasanchez@yahoo.es
RESUMEN
Introducción: Los tumores carcinoides de células caliciformes representan menos del 5% de los tumores primarios del apéndice. Son tumores raros y distintivos compuestos de células mucinosas con apariencia de anillo de sello que infiltran circunferencialmente el apéndice y expresan marcadores neuroendocrinos. El término carcinoide-adenocarcinoma mixto ha sido propuesto para designar a carcinomas del apéndice que se originan por progresión de un carcinoide de células de caliciformes preexistente. Método: hemos revisado las características histológicas, clínicas y la literatura médica. Secciones representativas han sido teñidas con hematoxilina-eosina, ácido peryódico de Schiff y azul alcian. El estudio inmunohistoquímico se realizó con el método estreptavidina-biotina-peroxidasa para Citoqueratina 20, cromogranina A, sinaptofisina y antígeno carcinoembrionario. Resultado: El tumor mostró un patrón de crecimiento carcinomatoso en más del 50% de su volumen. El estudio inmunohistoquímico (citoqueratina 20, cromogranina A, sinaptofisina y antígeno carcinoembrionario), ácido peryódico de Schiff y azul alcian fueron difusamente positivos. Conclusión: La inmunohistoquímica es de ayuda para diferenciar estos tumores del adenocarcinoma mucinoso y carcinoides.
Palabras clave: Apéndice, carcinoide-adenocarcinoma mixto, carcinoide.
SUMMARY
Background: Goblet cell carcinoids tumours accounts for less than 5% of primary tumors of the appendix. They are rare and distinctive tumours, composed of clusters of mucinous cells with a signet ring cell appearance that infiltrate the appendix circumferentially and express neuroendocrine markers. The term mixed carcinoid-adenocarcinoma has been proposed to designate carcinomas of the appendix that arise by progression from a pre-existing goblet-cell carcinoid. Methods: We have reviewed the histological features, clinical features and the medical literature. Representative sections were stained with hematoxylin-eosin, periodic-acid-Schiff and alcian blue. Immunohistochemical stains were performed by using the streptavidin-biotin peroxidase method for cytokeratin 20, chromogranin A, synaptophysin and carcinoembryonic antigen. Results: The tumour showed carcinomatous growth pattern in greater than 50% of total volume. Immunohistochemical stains (cytokeratin 20, chromogranin A, synaptophysin and carcinoembryonic antigen), periodic-acid-Schiff and alcian blue were diffusely positive. Conclusions: Immunohistochemical stains were helpful to separate these tumors from mucinous adenocarcinoma, signet-ring cell carcinoma and carcinoid tumours.
Keywords: Appendix, mixed carcinoid-adenocarcinoma, carcinoid.
INTRODUCCIÓN
La clasificación de la OMS (1) de los tumores endocrinos del apéndice cecal diferencia entre neoplasias endocrinas bien diferenciadas (tumores carcinoides clásicos) y neoplasias con diferenciación mixta endocrina y exocrina (carcinoide tubular, carcinoide con células en anillo de sello y carcinoide-adenocarcinoma mixto). Durante mucho tiempo ha sido objeto de debate la naturaleza e implicación pronóstica de la diferenciación mucinosa en los tumores carcinoides, de aquí que hayan sido reconocidos por una variedad de denominaciones tales como: tumor carcinoide mucinoso, adenocarcinoide, carcinoide de tipo intermedio, carcinoma microglandular, tumor compuesto y carcinoma de células de la cripta. Siguiendo esta premisa nosotros presentamos un tumor con extensa diferenciación mucinosa, positividad franca para marcadores neuroendocrinos y un comportamiento más cercano al carcinoma que al tumor carcinoide clásico, discutiendo cuales son los parámetros histológicos que vislumbran el pronóstico clínico y la nomenclatura apropiada para estos tumores.
DESCRIPCIÓN DEL CASO
Mujer de 62 años de edad, sin antecedentes clínicos de interés que acude al servicio de urgencia por rectorragia y dolor agudo en fosa iliaca derecha de características apendiculares. Se practica cirugía urgente.
Recibimos pieza de ileo-tiflectomía de 15 cm de longitud, plegada sobre si misma, mostrando intensa adherencia, a modo de brida, entre ciego e ileon terminal. Los cortes seriados muestran que dicha brida adherencial se encuentra constituida por un tejido firme blanquecino de apariencia tumoral y límites imprecisos que parece englobar apéndice cecal. La apertura de asas intestinales tan solo identifica erosión mucosa, sin neoformación luminal aparente.
Histológicamente, existe a nivel apendicular un crecimiento neoplásico subepitelial sin signos neoplásicos mucosos (fig. 1). Dicha proliferación está constituida por abundantes células mucinosas con morfología en «anillo de sello», células con citoplasma eosinófilo y ocasionales células de Paneth (fig. 2). Estas células se observan como elementos aislados o bien agrupadas en nidos sólidos o glandulares e hileras, siendo habituales las imágenes de infiltración perineural y permeación vascular linfática. El tumor infiltra concentricamente la pared apendicular extendiéndose ampliamente por tejido adiposo e infiltrando serosa y muscular propia de ileon terminal y ciego, haciéndose extensa en la submucosa de ambos (fig. 3). Además se observan abundantes ganglios linfáticos metastáticos (8 de 14 aislados), implantes tumorales en epiplon y lagos de mucina englobando nidos celulares que recuerdan al carcinoma (fig. 4). Las células tumorales muestran inmunorreactividad frente a los anticuerpos Citoqueratina 20, antígeno carcinoembrionario (CEA) y marcadores neuroendocrinos (sinaptofisina, cromogranina) (figs. 5 y 6) y se tiñen con ácido peryódico de Schiff (PAS) y Azul Alcian (fig. 7).
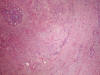
Fig. 1:
Infiltración tumoral concéntrica y submucosa de la pared del apéndice cecal.
Obsérvese la ausencia de signos displásicos en mucosa apendicular. HE 5X.
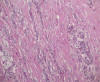
Fig. 2:
Células tumorales con morfología en «anillo de sello» y patrón de crecimiento
infiltrativo. HE 20X.
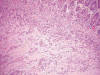
Fig. 3:
Infiltración tumoral de la pared del ciego con amplio crecimiento submucoso. HE
10X.
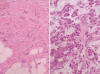
Fig. 4:
Infiltración tumoral del epiplon (foto de la izquierda) HE 10X; Nidos tumorales
fusionados, sin luces glandulares y sumergidos en un estroma mucinoso recordando
al carcinoma (foto de la derecha) HE 20X.

Fig. 5:
Positividad para Sinaptofisina en células neoplásicas con morfología en anillo
de sello. 20X.
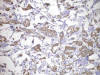
Fig. 6:
Positividad para Cromogranina en células neoplásicas. 20X.
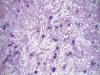
Fig. 7:
Células mucosecretoras con tinción positiva para azul alcian PAS. 20X.
DISCUSIÓN
El tumor carcinoide con diferenciación mucinosa fue descrito por vez primera por Gagne y cols (2) en 1969 al publicar tres casos de un tumor apendicular que mostraba tres características histológicas relevantes: asociación de estructuras glandulares con formación de moco y nidos de células enterocromafines, integridad de la mucosa apendicular y un patrón infiltrativo similar a los tumores carcinoides pero con mayor propensión a la invasión neural. Se ha discutido mucho acerca de cual es su naturaleza, si es un subtipo especial de adenocarcinoma o de tumor neuroendocrino, lo que ha supuesto diferentes nomenclaturas para el mismo. Así, mientras muchos autores lo consideran como una forma de tumor carcinoide, sobre la base de su diferenciación neuroendocrina y su patrón de crecimiento, otros como Misdraji e Isaacson (3,4) lo consideran como una forma de adenocarcinoma. En los últimos años los avances en biología molecular parecen aclarar este punto al demostrar que el tumor carcinoide con diferenciación mucinosa muestra anormalidades moleculares más afines al tumor carcinoide clásico que al adenocarcinoma, como son la perdida alélica en cromosoma 11q ,16q y 18q, la ausencia de mutación de K-ras, de Beta-catenina o DPC-4 (comunes en adenocarcinomas) y menor frecuencia de mutación P53 que la observada en el adenocarcinoma (5-7). Hoy día son muchos los autores que creen que tiene su origen en una célula pluripotencial de la cripta con diferenciación divergente neuroendocrina y mucinosa (8), siendo por tanto adecuado el término de neoplasia mixta exoendocrina que la OMS reconoce dentro del grupo de las neoplasias endocrinas y que a su vez divide en carcinoide tubular, carcinoide de células caliciformes y carcinoide-adenocarcinoma mixto en función de sus características histológicas (1).
El término carcinoide-adenocarcinoma mixto se usa para designar aquellos carcinomas de apéndice cecal originados a partir de un tumor carcinoide con diferenciación mucinosa preexistente; en este sentido Burke y col (9) definieron el patrón de crecimiento carcinomatoso en estos tumores como un crecimiento tumoral difuso o en hilera con fusión o patrón cribiforme glandular, presencia de lagos de mucina conteniendo estructuras glandulares fusionadas con ausencia de luz glandular (es decir similares a los observados en el adenocarcinoma mucinoso) y extensión más allá de los limites apendiculares. Misdraji (3) afirma que un tumor carcinoide con diferenciación mucinosa y un patrón de crecimiento carcinomatoso en más del 50% del tumor debe ser denominado carcinoide-adenocarcinoma mixto, reservando el término carcinoide de células caliciformes para neoplasias en las que falta este crecimiento carcinomatoso o según algunos autores éste es inferior al 25% del volumen tumoral (10). Estas diferencias terminológicas tienen relevancia clínica, así mientras tumores carcinoides clásicos, localizados y sin diferenciación mucinosa, tienen un excelente pronóstico con una supervivencia del 99% a los 5 años, ésta disminuye en carcinoides con diferenciación mucinosa (carcinoide de células de caliciformes) siendo aún menor cuando éstos tienen un crecimiento carcinomatoso (carcinoide-adenocarcinoma mixto), de hecho en una serie publicada por Burke y cols 12 de 14 pacientes con carcinoide-adenocarcinoma mixto murieron en un intervalo de 16 meses (9,11).
El diagnóstico diferencial debe hacerse con el adenocarcinoma mucinoso el cual, a pesar de mostrar características histológicas similares al carcinoide-adenocarcinoma mixto como son la presencia de fusión glandular y la falta de luces glandulares dentro de los lagos de mucina, presenta rasgos neoplásicos en la mucosa adyacente y un perfil molecular diferente (3,12).
Respecto al tratamiento parece existir consenso en que la hemicolectomía derecha postapendicectomía es el tratamiento de elección en el tumor carcinoide de células caliciformes cuando se cumple una o más de estas premisas: 1) escasa diferenciación tumoral, 2) alto índice mitósico, 3) afectación tumoral de la base del apéndice cecal, 4) metástasis en ganglios linfáticos y 5) tamaño tumoral mayor de 2 cm; por tanto, la simple invasión del mesoapendice, la invasión perineural o la permeación de vasos linfáticos no son indicativas por sí mismos para la realización de una hemicolectomía (13,14). Por su parte, el carcinoide-adenocarcinoma mixto debe entenderse y tratarse como un adenocarcinoma clásico de apéndice cecal.
En resumen presentamos un caso de tumor carcinoide de células caliciformes con un extenso crecimiento carcinomatoso (superior al 50%), siendo por tanto adecuado el término carcinoide-adenocarcinoma mixto y concluyendo que la diferenciación mucinosa en el tumor carcinoide debe tenerse en cuenta ya que implica peor pronóstico clínico que el tumor carcinoide clásico y mayor capacidad de comportamiento carcinomatoso.
BIBLIOGRAFÍA
Capella C, Solcia E, Sobin LH, Arnold R. Endocrine tumours of the appendix. En: Hamilton S and Aaltonen L, editor. World Health Organization Classification of Tumours. Tumours of the Digestive System. Lyon: IARCPress; 2000. p. 99-102.
Gagne F, Fortín P, Dufour V, Delage C. Tumeurs de l´appendice associant des carretteres histologiques de carcinoide et d´adenocarcinome. Ann Anat Pathol 1969; 14: 393-406.
Misdraji J. Neuroendocrin tumours of the appendix. Current Diagnostic Pathol. 2005; 11: 180-93.
Isaacson P. Cryp cell carcinoma of the appendix (so-called adenocarcinoid tumor). Am J Surg Pathol 1981; 5:213-24.
Stancu M, Wu TT, Wallace C. Genetic alterations in goblet cell carcinoides of the vermiform appendix and comparison whit gastrointestinal carcinoid tumors. Mod Pathol 2003; 16:1189-98.
Ramnani DM, Wistuba II, Behrens C, Gazdar AF, Sobin LH, Albores-Saavedra J. K-ras and p53 mutations in the pathogenesis of classical and goblet cell carcinoids of the appendix. Cancer. 1999; 86: 14-21.
Paraskevakou H, Saetta A, Skandalis K, Tseleni S, Athanassiadis A, Damaris P. Morphological-Histochemical Study of intestinal carcinoids and K-ras mutation analysis in appendiceal carcinoids. Pathol Oncol Res. 1999; 5: 205-10.
Kanthan R, Saxena A, Kanthan SC. Goblet cell carcinoids of the appendix: immunophenotype and ultrastructural study. Arch Pathol Lab Med. 2001; 125: 386-90.
Burke AP, Sobin LH, Federspiel BH, Shekitka KM, Helwig EB. Goblet cell carcinoids and related tumors of the vermiform appendix. Am J Clin Pathol. 1990; 94: 27-35.
Gordon R, Burns K, Friedlich M. Goblet cell carcinoid of the appendix. Can J Surg. 2005; 48: 251-2.
Pai RK, Longacre TA. Appendiceal mucinous tumors and pseudomyxoma peritonei: histologic features, diagnostic problems, and proposed classification. Adv Anat Pathol. 2005; 12: 291-311.
Lin BT, Gown AM. Mixed carcinoid and adenocarcinoma of the appendix: report of 4 cases with immunohistochemical studies and a review of the literature. Appl Immunohistochem Mol Morphol. 2004; 12: 271-6.
Pahlavan PS, Kanthan R. Goblet cell carcinoid of the appendix. World J Surg Oncol. 2005; 20: 36.
Pérez Alonso P, Blanco Alvarez JI, Aso Manso S. Tumor adenocarcinoide apendicular (subtipo de células caliciformes). Rev Esp Patol 2004; 37: 337-8.