
Vol. 40, n.º 3, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 3, 2007 |
|
Homenaje
al Dr. Francisco José Martínez Tello |
ORIGINALES
José I. López
Servicio de Anatomía Patológica. Hospital de
Basurto. Universidad del País Vasco (EHU/UPV). Avda. Montevideo, 18. 48013
Bilbao.
joseignacio.lopez@ehu.es
RESUMEN
Antecedentes: Los conductos eyaculadores son dos estructuras anatómicas mayoritariamente intraprostáticas, pero de origen extraprostático, cuya patología, congénita o adquirida, es causa frecuente de esterilidad masculina, lo cual ha justificado la mayoría de estudios clínicos y radiológicos publicados hasta la fecha. Los patólogos tienen un contacto cada vez más frecuente con ellos debido al incremento en el número de prostatectomías radicales, pero su desconocimiento anatómico es grande y la repercusión clínica de su invasión por el cáncer de próstata, poco valorada. Métodos: Se estudian cortes histológicos seriados de 20 próstatas de cadáver y de 37 prostatectomías radicales con invasión de las vesículas seminales, y se describen los hallazgos encontrados en los conductos eyaculadores desde su ingreso en la próstata hasta su desembocadura en la uretra. Resultados: La pared intraprostática de los conductos eyaculadores consta de una capa mixta, circunferencial y longitudinal, de fibroblastos que incluye aisladas fibras musculares lisas longitudinales. Esta capa es individual en su inicio y compartida después, y los separa nítidamente de la próstata. El epitelio es similar al de las vesículas seminales, y la lámina propia contiene nervios, arterias, venas y linfáticos propios. En su parte final, el esqueleto muscular del verumontanum, las glándulas periuretrales locales, el utrículo prostático, y los citados conductos eyaculadores constituyen un laberinto morfológico que está sujeto a múltiples variaciones individuales. La invasión de los mismos por el cáncer de próstata es un hecho poco frecuente que favorece la diseminación extraprostática de la neoplasia. Conclusiones: Por la trascendencia clínica que tiene su invasión por el cáncer de próstata, los conductos eyaculadores deben ser incluidos de manera rutinaria, y evaluados intencionadamente en el estudio de las piezas de prostatectomía radical.
Palabras clave: Conductos eyaculadores, verumontanum, anatomía microscópica, cáncer de próstata, pronóstico.
SUMMARY
Background: Ejaculatory ducts are two intraprostatic anatomical structures with an extraprostatic origin which are frequently involved in male sterility. This fact is the cause of most of the clinical and radiological studies published so far. Today, pathologists are frequently faced with ejaculatory ducts because of the increasing number of radical prostatectomies received in Pathology Labs, but its detailed knowledge is not generalised and its clinical impact underestimated. Methods: Consecutive histological slides of the prostate obtained from 20 human cadavers and 37 radical prostatectomies with prostate cancer invading the seminal vesicles were studied paying special attention to the ejaculatory ducts, from its entrance in the prostate to its end in the verumontanum. Results: The intraprostatic wall of ejaculatory ducts is composed by a double sheath (longitudinal and circumferencial) of fibroblasts including some longitudinal smooth muscle fibres. This sheath is individual at the beginning and later common to both ducts, and clearly separates the ejaculatory ducts from the prostatic tissue. The epithelium is similar to that of seminal vesicles, and the lamina propria contains nerves, arteries, veins and lymphatics. The skeletal muscle of the verumontanum, the local periurethral glands, the prostatic utricle, and the ends of both ejaculatory ducts constitute a morphological labyrinth with wide individual variations. The ejaculatory duct invasion by prostate cancer is a rare event that favours the extraprostatic extension. Conclusions: Due to the clinical importance of the ejaculatory duct invasion by prostate cancer, these structures should be sampled in depth and evaluated intentionally in the routine practice.
Key words: Ejaculatory ducts, verumontanum, microscopic anatomy, prostate cancer, prognosis.
INTRODUCCIÓN
Aparte de los estudios anatómicos clásicos (1), la literatura médica relacionada con los conductos eyaculadores está referida esencialmente a la esterilidad masculina (2-5), y a cómo diagnosticarla (6,7) y tratarla (8). Aunque no existen hasta la fecha casos documentados de adenocarcinomas derivados de los conductos eyaculadores, el crecimiento espectacular en la incidencia del adenocarcinoma de próstata y, por ende, la llegada a los Servicios de Anatomía Patológica de un número creciente de prostatectomías radicales ha puesto al patólogo práctico en contacto casi diario con esta estructura anatómica.
Existen estudios recientes que reivindican la importancia de los conductos eyaculadores como vías de diseminación facilitada o preferente del cáncer de próstata (9-11), lo cual ha resucitado para el patólogo un interés por esta estructura que prácticamente sólo compartían anatomistas, radiólogos, y expertos en fertilidad.
En este trabajo se detallan las características anatómicas de los conductos eyaculadores en su porción intraprostática y se revisa su papel en relación al cáncer de próstata.
MATERIAL Y MÉTODOS
Se estudian cortes histológicos seriados correspondientes a las porciones proximal (entrada en la próstata), media (en el espesor de la próstata), y distal (en el verumontanum) de los conductos eyaculadores en 20 próstatas de cadáver sin patología prostática conocida y en un subgrupo de 37 prostatectomías radicales con invasión neoplásica de las vesículas seminales encontradas entre 363 piezas quirúrgicas analizadas a lo largo de 8 años (1998-2005). La selección específica de estos casos quirúrgicos pretende analizar la supuesta implicación de los conductos eyaculadores en la diseminación microscópica del cáncer hacia las vesículas seminales (9-11), hecho que convierte al cáncer prostático estadio pT2 en estadio pT3b. Asimismo, se seleccionan un número de biopsias transrectales suficientes para ilustrar la presencia de los conductos eyaculadores en este material tan escaso y tan frecuente en la práctica diaria. Se incluye también el punto de vista del radiólogo (fig. 1).
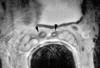
Fig. 1:
Imagen de resonancia magnética con bobina endorrectal que identifica las
vesículas seminales y los conductos eyaculadores (flechas).
El material a estudio se fija en formalina y se incluye en parafina siguiendo procedimientos rutinarios. Las próstatas de cadáver se incluyen en su totalidad en lonchas de una sola pieza. Las prostatectomías radicales se muestrean siguiendo el protocolo local del Servicio de Anatomía Patológica del Hospital de Basurto. Se analiza por un lado la morfología de la vaina que incluye los conductos eyaculadores y sus relaciones y, por otro, la relación de éstos con el cáncer de próstata en el caso que éste llegue a afectarlos. Los cortes histológicos se tiñen con hematoxilina-eosina y, en casos seleccionados, con tricrómico de Masson, reticulina de Gomori, y PAS con digestión diastasa previa. Ocasionalmente, se realizan tinciones inmunohistoquímicas con proteína S-100 para evaluar los tractos nerviosos y con PSA para diferenciar el tejido prostático neoplásico de los conductos eyaculadores (12).
Se evalúa en cada caso, el epitelio, la lámina propia, los vasos linfáticos, arteriales y venosos, los nervios, la vaina fibrosa y los haces musculares lisos. Siguiendo los mismos criterios de Epstein y cols (13) para las vesículas seminales, sólo se considera invasión de los ductos la afectación neoplásica de la vaina fibromuscular. En el caso de que el adenocarcinoma de próstata afecte masivamente a la glándula e incluya a los conductos eyaculadores en su crecimiento dificultando su identificación, ésta se llevará a cabo mediante la detección del típico pigmento lipofucsínico citoplásmico o, en casos dudosos, mediante la negatividad en la tinción inmunohistoquímica con PSA.
RESULTADOS
Anatomía microscópica de los conductos eyaculadores
Zona proximal (fig. 2A). Los conductos eyaculadores entran en la próstata adyacente el uno al otro, aunque la cubierta fibrosa que los rodea sea, a este nivel, independiente para cada uno de ellos. La cubierta pierde la capa muscular lisa típica de las vesículas seminales y de los conductos deferentes vecinos, aunque se identifican aislados tractos musculares en disposición longitudinal. En el tejido laxo que engloba a los conductos eyaculadores se identifican arterias de pared gruesa y hialina, venas y linfáticos acompañantes, así como tractos nerviosos. El epitelio es de tipo columnar con abundantes plegamientos.
Zona media (fig. 2B). En esta porción, los conductos eyaculadores se sitúan muy próximos uno al otro, atraviesan primero parte de la zona central, muy musculosa y con glándulas prostáticas complejas, y acceden después al tejido fibroso que separa sutilmente las zonas periférica y transicional. La capa de tejido fibroso es más delgada y engloba a ambos conductos. No obstante, se observa cierta independencia entre ambos acentuada por la distribución circunferencial de los vasos linfáticos. Las arterias de pared gruesa y hialina se localizan en la zona más central, entre ambos conductos. El epitelio no presenta diferencias respecto de lo dicho de la zona proximal.
Zona distal (fig. 2C). En esta área aparece en la línea media la cavidad del utrículo prostático y flanqueándolo, a derecha e izquierda, ambos conductos eyaculadores, por lo que ambos están algo más separados entre sí que en la porción medial. La orientación del corte puede ofrecer secciones más o menos oblicuas de ambas estructuras. El utrículo tiene una longitud, anchura, y morfología variables, su epitelio puede estar adelgazado o presentar hiperplasia de células basales. Los vasos linfáticos se mantienen, pero las arterias de pared gruesa y hialina desaparecen; además se observan fibras musculares lisas desperdigadas. El epitelio que tapiza los conductos es similar al descrito anteriormente.
![]()
Fig. 2:
Imagen de pequeño aumento de los conductos eyaculadores en corte transversal. A)
la zona proximal muestra ambos conductos inmersos en un tejido laxo, con capa
fibromuscular individual. Se identifican abundantes vasos linfáticos y arterias
de pared gruesa (tricrómico de Masson, x25). B) la zona media presenta a ambos
conductos dentro de la misma vaina fibrosa. Se mantienen las arterias de pared
gruesa y la abundancia de vasos linfáticos (hematoxilina-eosina, x25). C) la
zona distal incluye al utrículo prostático. Las arterias de pared gruesa han
desaparecido. La vaina fibrosa es común a las tres estructuras
(hematoxilina-eosina, x25).
Anatomía microscópica del verumontanum
Un corte longitudinal y seriado del verumontanum es el más apropiado para evaluar su arquitectura. A la triada de utrículo prostático central y conductos eyaculadores laterales, se añaden un conjunto de glándulas periuretrales características de esta zona (fig. 3A) en número variable dependiendo de cada caso. Se trata de glándulas de morfología compleja, a menudo conteniendo cuerpos amiláceos, que muestran una estructura en bicapa celular muy aparente, con la hilera luminar compuesta por células de citoplasma claro. Dependiendo del nivel de corte, aparece una estructura muscular compuesta por fibras de tipo músculo liso en banda formando el esqueleto central del verumontanum (fig. 3B). Dicho espolón muscular corresponde a la parte final del músculo trigonal superficial de la vejiga urinaria (3). Además, otros dos músculos laterales paralelos (fig. 3C) que se originan en el verumontanum y acaban distalmente en la uretra, completan el cuadro histológico de la zona.
![]()
Fig. 3:
Imagen de pequeño aumento del verumontanum en corte longitudinal. A) hiperplasia
de glándulas locales. Se observan indicios de la banda muscular longitudinal
(hematoxilina-eosina, x25). B) banda muscular longitudinal (hematoxilina-eosina,
x25). C) bandas musculares laterales con el utrículo prostático en el centro y
los conductos eyaculadores en situación lateral al pie de la foto
(hematoxilina-eosina, x25).
Los conductos eyaculadores en las biopsias transrectales
Aunque la punción transrectal muestrea una ínfima parte de la glándula prostática, la presencia de los conductos eyaculadores en los cilindros resultantes es bastante frecuente. No sólo se pueden identificar cuando se incluye en la muestra el típico epitelio plegado y pigmentado (fig. 4A). El reconocimiento del tejido fibroso laxo y con abundantes espacios linfáticos, muchas veces orientados en el mismo eje y sin haces musculares (fig. 4B), garantiza la extrema proximidad de la luz del conducto. Más aún, la identificación de haces nerviosos junto con arterias de mediano calibre con engrosamiento hialino de su pared (fig. 4B) también indica la cercanía del conducto. Esta configuración histológica es exclusiva de la vaina del conducto eyaculador. No existe en todo el parénquima prostático ningún área semejante, lo cual permite su identificación en muestras pequeñas independientemente de si el epitelio típico está representado o no en la biopsia.
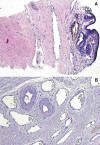
Fig. 4:
Detalle microscópico de un conducto eyaculador y su vaina fibrosa. A) cilindro
biopsia en el que aparece el epitelio típico pigmentado del conducto. Entre éste
y el tejido muscular liso de la próstata aparece un tejido fibroso laxo
característico con vasos linfáticos comprimidos y aisladas arterias
(hematoxilina-eosina, x250). B) detalle histológico de la abundancia de vasos
linfáticos y de las características arterias de pared gruesa
(hematoxilina-eosina, x250).
La invasión neoplásica de los conductos eyaculadores
El subgrupo de adenocarcinoma de próstata con invasión de vesículas seminales seleccionado para el estudio está constituido por 37 casos, lo cual corresponde a un 10,2% de los adenocarcinomas de próstata tratados mediante cirugía radical en nuestro centro. En 3 casos (8,1%) de este subgrupo, además de invasión microscópica de las vesículas seminales, se detecta invasión de conducto eyaculador (fig. 5A). La presencia de pigmento citoplásmico es suficiente para identificar en estos casos al conducto eyaculador entre el cáncer en aquellos que presentan invasión neoplásica masiva (fig. 5B).
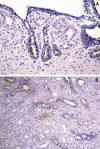
Fig. 5:
Detalle histológico de la invasión de los conductos eyaculadores por el
adenocarcinoma de próstata. A) Invasión focal subepitelial (hematoxilina-eosina,
x400). B) Invasión masiva ahogando los restos de los conductos
(hematoxilina-eosina, x250).
DISCUSIÓN
En el desarrollo embriológico, el epidídimo, el conducto deferente, y el conducto eyaculador derivan del conducto mesonéfrico (Wolffiano) y forman una unidad. Éste último discurre caudalmente a lo largo de la cresta mesonéfrica y, al aproximarse al seno urogenital, se fusiona con el del otro lado en el espacio situado entre la vejiga por delante y el recto por detrás formando un tabique transversal que se denomina cordón genital. Pues bien, los conductos eyaculador y deferente se originan de este cordón. En el tercer mes del desarrollo, la próstata, glándula de origen mixto endodérmico y mesodérmico, abraza a los conductos eyaculadores interiorizándolos en su espesor. Por lo tanto, del simple recuerdo embriológico se puede deducir un hecho que hoy en día está plenamente vigente, a saber, que los conductos eyaculadores corresponden a tejido extraprostático dentro de la próstata.
Los conductos eyaculadores, en el adulto, tienen una longitud aproximada de 2 cm, se sitúan uno a cada lado del plano medio y discurren en sentido antero-inferior desde la parte posterior de la base de la próstata hasta el verumontanum (14). Allí desembocan en la uretra flanqueando al utrículo prostático, que es una estructura derivada del conducto paramesonéfrico (Mülleriano). Los conductos están tapizados por el mismo epitelio que las vesículas seminales (15). La desembocadura en el verumontanum, no forma un ángulo recto con la uretra, sino que lo hace de manera ligeramente oblicua, con una dirección favorable al sentido del flujo hacia la uretra peneana. Se desconoce en qué medida la hiperplasia adenomiomatosa de la próstata, hecho que ocurre indefectiblemente a partir de determinada edad aunque ésta no dé síntomas, modifica la longitud y la morfología de los conductos eyaculadores. La mayor parte de los estudios anatómicos se realizan en próstatas de edades en las que cierto grado de hiperplasia ya se ha instaurado, y no existen estudios que comparen las próstatas de varones en la segunda década de la vida con próstatas de hombres en la sexta, por ejemplo.
El adenocarcinoma que se origina en los acinos o en los ductos de la próstata es prácticamente la única neoplasia maligna que afecta a la glándula prostática. No existen casos documentados de adenocarcinomas derivados del conducto eyaculador, y los casos de carcinoma derivados del utrículo prostático y glándulas locales son anecdóticos (16). La diseminación del cáncer es mayoritariamente por vía linfática, y ya en 1953, Franks (17) llamó la atención sobre las comunicaciones entre el plexo prostático y los plexos venosos extradurales, lo que podría justificar la tendencia del cáncer de próstata a desarrollar metástasis óseas vertebrales. En un estudio reciente utilizando métodos inmunohistoquímicos, Fukuda y cols. (18) demuestran cómo la vaina de los conductos eyaculadores son, con mucho, las áreas con mayor densidad de vasos linfáticos de toda la próstata, seguidos en orden decreciente por la cápsula prostática.
Teniendo en cuenta todo lo anterior, parece evidente la gran relevancia que tiene la invasión neoplásica de la vaina de los conductos eyaculadores en la evolución clínica del adenocarcinoma de próstata. Si por un lado se considera al conducto eyaculador como tejido extraprostático dentro de la próstata y, por otro, se demuestra que éste contiene la más alta densidad de vasos linfáticos de toda la glándula, será fácil justificar los recientes hallazgos de Amin y cols (9,10) y Billis y cols (11) en los que se detecta una mayor tendencia a mostrar extensión extraprostática en aquellos cánceres que invaden el conducto eyaculador respecto de aquellos otros que no lo invaden. En este sentido, no sería de extrañar que en próximas ediciones de la clasificación TNM de los tumores prostáticos, se contemplase al cáncer de próstata con invasión del conducto eyaculador como cáncer en estadio pT3, o cáncer no confinado al órgano. En su estudio, Fukuda y cols (18) señalan además que no se identifican vasos linfáticos en vecindad a los acinos prostáticos, y que la primera evidencia de estas estructuras en el tejido prostático se produce en los septos conectivos interacinares, lo cual justificaría la quiescencia evolutiva de algunos carcinomas con índices de Gleason bajos localizados en la zona periférica.
La identificación de la invasión neoplásica de los conductos eyaculadores debe ser, por lo tanto, intencionada en cada pieza de prostatectomía radical, y también en aquellos aislados casos en los que la casualidad haga que el conducto eyaculador, o su vaina, aparezcan en la biopsia transrectal. El reconocimiento del cáncer invadiendo el conducto puede pasar fácilmente desapercibido. En los casos con invasión mínima por razones obvias, y en los casos de invasión masiva, como en aquellos cánceres que aún siendo intraprostáticos ocupan extensas áreas de la glándula, por la dificultad que supone identificar los restos de los conductos eyaculadores ahogados en el magma neoplásico. Se ha propuesto para ello la inmunotinción con antígeno específico prostático (PSA) y la identificación de pigmento lipofucsínico (12), pero se han descrito positividades para PSA y fosfatasa ácida prostática en los conductos eyaculadores (19) y adenocarcinomas prostáticos que contienen pigmento (20), con lo cual el valor de ambos métodos se ve seriamente cuestionado. En este sentido, la inmunorreactividad con MUC-6 (21) parece más fiable.
CONCLUSIÓN
Los conductos eyaculadores son estructuras independientes de la próstata aunque estén englobados dentro de la misma, tienen una histología propia, diferente del tejido prostático adyacente, y son fácilmente identificables. Por su conexión directa con las vesículas seminales, por la especial textura del tejido conectivo del que está constituido su vaina, y por la abundancia de vasos linfáticos que contiene, estas estructuras juegan un papel muy importante en la diseminación del cáncer de próstata, y su estudio sistematizado en las piezas de prostatectomía radical debería generalizarse en los laboratorios de Anatomía Patológica de nuestros hospitales.
BIBLIOGRAFÍA
Aboul-Azm TE. Anatomy of the human seminal vesicles and ejaculatory ducts. Arch Androl 1979; 3: 187-292.
Suzuki T, Kurokawa K, Takahashi O, Yajiima H, Ito H, Yamanaka H. Changes in prostatic thickness and the location of ejaculatory ducts in autopsy prostates. Br J Urol 1995; 75: 647-50.
Nguyen HT, Etzell J, Turek PJ. Normal human ejaculatory duct anatomy: a study of cadaveric and surgical specimens. J Urol 1996; 155: 1639-42.
Fisch H, Kang YM, Johnson CW, Goluboff ET. Ejaculatory duct obstruction. Curr Opin Urol 2002; 12: 509-15.
Mancinelli R, Usai P, Vargiu R, De Lisa A, Scarpa RM, Usai E. Human ejaculatory duct: parameters of smooth muscle motor activity and modulatory role of autonomic drugs. Exp Physiol 2000; 85.4: 465-7.
Lee F, Torp-Pedersen ST, McLeary RD. Diagnosis of prostate cancer by transrectal ultrasound. Urol Clin North Am 1989; 16: 663-73.
Villers A, Terris MK, McNeal JE, Stamey TA. Ultrasound anatomy of the prostate: the normal gland and anatomical variations. J Urol 1990; 143: 732-8.
Schroeder-Printzen I, Ludwig M, Köhn F, Weidner W. Surgical therapy in infertile men with ejaculatory duct obstruction: technique and outcome of a standardized surgical approach. Hum Reprod 2000; 15: 1364-8.
Amin MB, de-Peralta Venturina M, Killeen TC, Merchant SH, Ro JY, Ayala AG. Pathologic significance of the invaginated extraprostatic space involvement by prostate carcinoma. A study of 79 cases of stage T3b prostatic carcinomas. Mod Pathol 2005; 18: 579A.
Amin MA, Venturina M, Goldstein N, Dulai M, Merchant SH, Malhotra R. The incidence and significance of the invaginated extraprostatic space (IES) involvement by prostatic adenocarcinoma (PCA) in a series of 310radical prostatectomies. Mod Pathol 2006; 19: 128A.
Billis A, Stelini RF, Teixeira DA, Perina RC, Magna LA, Ferreira U. Seminal vesicle invasion in radical prostatectomies: which is the most common route of invasion. Mod Pathol 2006; 19: 131A.
Shidham VB, Lindholm PF, Kajdacsy-Balla A, Basir Z, George V, Garcia FU. Prostate-specific antigen expression and lipochrome pigment granules in the differential diagnosis of prostatic adenocarcinoma versus seminal vesicle-ejaculatory duct epithelium. Arch Pathol Lab Med 1999; 123: 1093-7.
Epstein JI, Carmichael M, Walsh PC. Adenocarcinoma of the prostate invading the seminal vesicles: definition and relation of the tumor volume, grade and margins of resection to prognosis. J Urol 1993; 149: 1040-5.
Trainer TD. Testis and excretory duct system. In: Sternberg SS ed. Histology for Pathologists, 2nd Edition, Lippincott-Raven, Philadelphia, 1997: 1019-37.
Cossu M, Marcello MF, Usai E, Testa Riva F, Riva A. Fine structure of the epithelium of the human ejaculatory duct. Acta Anat 1983; 116: 225-33.
Gualco G, Ortega V, Ardao G, Cravioto F. Clear cell adenocarcinoma of the prostatic utricule in an adolescent. Ann Diagn Pathol 2005; 9: 153-6.
Franks LM. Spread of prostatic cancer to bone. J Path Bact 1953; 66: 91-3.
Fukuda H, Yamada T, Kamata S, Saitoh H. Anatomic distribution of intraprostatic lymphatics: implications for the lymphatic spread of prostate cancer. A preliminary study. Prostate 2000; 44: 322-7.
Varma M, Morgan M, O’Rourke D, Jasani B. Prostate specific antigen (PSA) and prostate specific acid phosphatase (PSAP) immunoreactivity in benign seminal vesicle/ejaculatory duct epithelium: a potential pitfall in the diagnosis of prostate cancer in needle biopsy specimens. Histopathology 2004; 44: 405-6.
Mahmoodi M, Zhang S, Salim S, Hou JS, García FU. Lipofuscin pigment can be used as a prognostic marker in prostatic adenocarcinoma. Ann Diagn Pathol 2006; 10: 257-62.
Leroy X, Ballereau C, Villers A, Saint F, Aubert S, Gosselin B, Porchet N, Copin MC. MUC6 is a marker of seminal vesicle-ejaculatory duct epithelium and is useful for the differential diagnosis with prostate adenocarcinoma. Am J Surg Pathol 2003; 27: 519-21.