
Vol. 40, n.º 2, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 2, 2007 |
REVISIONES
María Teresa Fernández-Figueras
Hospital Universitari Germans Trias i Pujol,
Crta. Canyet s/n. Badalona. 08916 Barcelona. España.
20669mtf@comb.es
RESUMEN
En la actualidad, una de las causas más frecuentes de biopsia en la patología cutánea no tumoral son las reacciones cutáneas a fármacos o cosméticos. Además, la continua aparición de nuevos tratamientos farmacológicos y cosméticos obliga a estar preparado para reconocer sus posibles efectos adversos en la piel. Éstos pueden manifestarse en forma de prácticamente todas los patrones histopatológicos e incluso desencadenando la aparición de una dermatosis en individuos propensos a ésta. El diagnóstico de las toxicodermias se basa, como en la gran mayoría de enfermedades dermatológicas, en la correlación clínico-patológica. No obstante, existen unos hallazgos microscópicos que nos pueden sugerir esta posibilidad diagnóstica como por ejemplo la eosinofilia, la disqueratosis y la asociación de patrones histopatológicos inhabituales o aparentemente incongruentes.
Palabras clave: Fármacos, cosméticos, piel, reacción, toxicodermia.
SUMMARY
At the present time, one of the leading causes of biopsy among non-tumoral dermatological diseases is skin reaction to cosmetics or drugs. Due to the continuous advent of new pharmacological treatments and the appearance of novel cosmetic procedures, pathologists must be prepared to recognize their cutaneous adverse reactions. These reactions can adopt practically every histopathological pattern and even trigger the appearance of a dermatosis in a predisposed individual. As in most other dermatological diseases, the diagnosis of cutaneous adverse drug reactions is based on clinico-pathological correlation. Nevertheless, there are some histopathological clues that can suggest this diagnosis such as the presence of eosinophilia and/or dyskeratosis and the combination of unusual and apparently incongruent histopathological patterns.
Key words: Drugs, cosmetics, skin, reaction, adverse.
INTRODUCCIÓN
En nuestra sociedad, tanto los tratamientos farmacológicos como los cosméticos son usados con toda naturalidad en la vida diaria y la frontera entre ellos se diluye cada vez más. Desde los simples antitérmicos o los protectores solares, hasta los más sofisticados tratamientos «biológicos» o los implantes de relleno, sin olvidar los llamados «remedios naturales». Pese a la apariencia inocua de muchos de ellos, cada vez son más comunes las patologías causadas por sus efectos adversos o colaterales, que adoptan un amplio espectro de formas clínicas e histopatológicas, siendo su diana más frecuente la piel y la biopsia cutánea es una excelente herramienta para reconocerlos. No obstante, es preciso recordar que a menudo no existen criterios histológicos o inmunológicos patognomónicos que permitan excluir otras causas alternativas. Por lo tanto, para establecer el diagnóstico definitivo será preciso tener en cuenta también los datos clínicos, especialmente la patología de base del paciente, la zona de aplicación de los tratamientos tópicos y la relación temporal, dado que en la mayor parte de casos las lesiones se desarrollan en las primeras dos semanas de tratamiento. Los fármacos más frecuentemente involucrados en estas reacciones son los antinflamatorios no esteroideos, los antibióticos y los anticonvulsivantes. La información clínica es especialmente importante en los casos en que la reacción al fármaco o cosmético simula a otra patología dermatológica de la que puede llegar a ser indistinguible desde un punto de vista histopatológico, como sucede con algunas enfermedades ampollosas, el lupus eritematoso etc. Por otro lado, existen tests cutáneos alergológicos tipo «patch-test», «foto-patch-test» y «prick-test» que pueden contribuir a confirmar esta asociación (1).
BASES FISIOPATOLÓGICAS Y PATRONES HISTOLÓGICOS DE LAS TOXICODERMIAS
Las reacciones cutáneas a fármacos o cosméticos pueden mostrar prácticamente todas las alteraciones histopatológicas conocidas facilitando, en algunos casos, la aparición de una dermatosis a la que el individuo en cuestión tenía propensión de antemano.
El patrón histológico más frecuentemente causado por fármacos es el de tipo liquenoide con daño vacuolar en la basal epidérmica, apoptosis queratinocitaria e infiltrado superficial de linfocitos grandes y de aspecto «activado». Estos linfocitos son CD4+ y tienen un papel fundamental en el daño de la interfase dermoepidérmica y la apoptosis (2,3), debido a su acción citotóxica mediada por proteínas como perforina o granzima B. No obstante, los linfocitos T CD8+ también son estimulados en muchas de estas reacciones y parecen tener un papel especialmente relevante en los exantemas bullosos (3,4). Además, en muchas toxicodermias se produce un incremento local de niveles de citocinas tipo I, como el interferón gamma, o tipo II, como la interleucina 5, que junto con otras citocinas facilitan la eosinofilia local (2,3). Ésta constituye una de las pistas más fiables para identificar las reacciones a fármacos. Otros hallazgos que pueden sugerirnos este diagnóstico son la presencia de células plasmáticas, la extravasación eritrocitaria o el edema en dermis alta. Pero probablemente el rasgo más característico de las toxicodermias es, precisamente, la tendencia a combinar varios tipos de patrones inflamatorios debido a que las alteraciones inmunológicas afectan a múltiples vías y en diferentes niveles.
Toxicodermias liquenoides
Se caracterizan por presentar daño vacuolar y apoptosis en la basal epidérmica. La apoptosis puede ser «ascendente» es decir los cuerpos apoptóticos tienen tendencia a emigrar progresivamente hacia la superficie cutánea, de manera que en una lesión de un cierto tiempo de evolución podremos reconocerlos en estratos altos de epidermis e incluso en la capa córnea. O bien, «descendente», con eliminación de los cuerpos apoptóticos a dermis papilar, en donde siguen siendo visibles durante un corto periodo de tiempo. Cuando las lesiones biopsiadas son antiguas, es posible que no persista el daño liquenoide en la basal. En este caso, nos ayudará a hacer el diagnóstico el buscar los cuerpos apoptóticos en la capa córnea o en las papilas dérmicas.
El prototipo de este patrón son las lesiones «tipo liquen plano» con infiltrado linfoide en banda en unión dermoepidérmica que suele ser poco denso, aunque puede ser tan intenso que llega a «oscurecerla» por completo, haciéndola invisible. A menudo existe hipergranulosis con hiperqueratosis ortoqueratósica como en el liquen plano. La presencia de eosinófilos y/o células plasmáticas y la paraqueratosis, poco habituales en el liquen plano, nos orientan hacia una causa medicamentosa. Cuando las células plasmáticas son más evidentes que los eosinófilos, debemos plantearnos el diagnóstico diferencial con una sífilis. Otro dato que permite sospechar toxicodermia es la extensión del infiltrado inflamatorio hacia dermis profunda (predominantemente perivascular).
El eritema fijo pigmentario es una forma clínicamente muy característica de reacción a fármacos. Habitualmente se limita a una única lesión o un pequeño número de éstas que aparecen siempre la misma localización y en relación a la ingesta de un mismo tipo de fármaco. Tras cada episodio dejan una pigmentación residual que, de repetirse en muchas ocasiones, puede ser muy intensa. Microscópicamente, en la fase activa el daño liquenoide y la eosinofilia son prominentes, la apoptosis es «ascendente y descendente» con numerosos cuerpos apoptóticos dispersos por la epidermis y en dermis pueden identificarse algunos neutrófilos (fig. 1). Si se realiza una biopsia tras la remisión de uno de estos episodios sólo se identifican numerosos melanófagos en dermis profunda, que son los responsables de la hiperpigmentación residual.
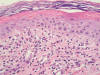
Fig. 1:
Erupción fija por fármacos con daño liquenoide basal y apoptosis ascendente y
descendente, como se puede apreciar por la presencia de cuerpos apoptóticos en
dermis papilar y en capa córnea. Se trata de una lesión relativamente reciente,
por lo que existen muy pocos melanófagos en la base.
El eritema exudativo multiforme (EEM) puede aparecer en relación con diferentes desencadenantes, siendo los más frecuentes son las infecciones herpéticas y los fármacos. Como su nombre indica, el aspecto histopatológico del EEM posee una gran variabilidad. La apoptosis queratinocitaria puede ser escasa o muy abundante y generalmente no se limita a la capa basal. El infiltrado linfoide suele ser moderado y de localización predominantemente perivascular superficial, con leve tendencia a la exocitosis a la epidermis. Un hallazgo habitual es la presencia de edema dérmico superficial que al ser eliminado a través de la epidermis hace que los queratinocitos basales queden comprimidos y alongados, disponiéndose verticalmente, perpendiculares a la epidermis, como si se tratara de una empalizada. Con cierta frecuencia se observan ampollas subepidérmicas causadas por la apoptosis queratinocitaria o el edema. La concentración de cuerpos apoptóticos en los acrosiringios es un dato que sugiere el origen medicamentoso (5). La forma más severa de EEM es el síndrome de Steven-Johnson, con afectación a menudo sistémica incluyendo mucosas. Al microscopio son lesiones con tendencia a la formación de ampollas que son propensas a la ulceración, lo que pone en riesgo la vida del paciente que debe considerarse como si de un quemado grave se tratara. Para algunos autores la necrolisis epidérmica tóxica (NET) o síndrome de Lyell sería equivalente al anterior (síndrome de Steven-Johnson), aunque clásicamente se considera que en la NET la necrosis queratinocitaria es aún más difusa afectando a todo el espesor epidérmico e incluso al epitelio de ductos sudoríparos, prácticamente sin infiltrado linfoide acompañante (6). La histología de ambos cuadros en muchos casos es superponible y los criterios clínicos, como la extensión de la zona afectada de piel ayudan a distinguirlas.
Algunos pacientes desarrollan lesiones de tipo lupus eritematoso en relación con la ingesta de fármacos. La apariencia clínica y microscópica, los hallazgos de laboratorio y la inmunofluorescencia pueden ser idénticos a los propios de esta enfermedad, lo que plantea la posibilidad de que en ocasiones se trate de auténticos brotes de lupus eritematoso desencadenados por el fármaco, en pacientes propensos a desarrollarlo (7). El diagnóstico puede ser difícil dado que el intervalo entre la instauración del tratamiento y el inicio de los síntomas puede ser muy largo (8).
Los cuadros de fototoxia son causados por una exposición solar tras la ingesta o aplicación tópica de determinados fármacos con tendencia a causar fotosensibilidad. Poseen un aspecto histológico similar al de las quemaduras solares con escaso infiltrado inflamatorio y un número variable de células apoptóticas en la basal que en este contexto se denominan «sunburn-cells» (células de quemadura solar) (fig. 2).
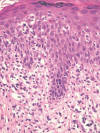
Fig. 2:
En las erupciones fototóxicas característicamente se identifican queratinocitos
apoptóticos que a menudo conservan restos picnóticos del núcleo en su interior,
iguales a los de las quemaduras solares.
Finalmente, el eritema acral o eritrodisestesia es un cuadro clínicopatológico característico que aparece fundamentalmente en palmas y plantas de individuos en tratamiento con antineoplásicos. El hallazgo microscópico más llamativo es la dismaduración epidérmica (fig. 3), usualmente con siringometaplasia escamosa, asociada a una dermatitis liquenoide leve. Este aspecto microscópico tan peculiar se ha descrito también en erupciones clínicamente morbiliformes que aparecen en pacientes sometidos a este tipo de tratamiento (9).
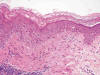
Fig. 3:
La alteración de la maduración epidérmica en este caso de eritema acral es tan
intensa que el daño liquenoide puede pasar desapercibido. El pleomorfismo e
hipercromasia nucleares y las mitosis en estratos altos de epidermis son
semejantes a los de la enfermedad de Bowen.
Toxicodermias espongióticas
La espongiosis es un hallazgo común en muchas las toxicodermias, pero sólo suele ser prominente en las dermatitis de contacto producidas por tratamientos farmacológicos o cosméticos tópicos, pudiendo ser debida al excipiente, y en las erupciones fotoalérgicas en las que puede llegar a producirse una auténtica espongiosis eosinofílica.
En los exantemas morbiliformes también suele observarse una cierta espongiosis. Estos pacientes a menudo refieren la ingesta de un antitérmico en relación con un cuadro viral; resulta extremadamente difícil responder al clínico que nos pide que diferenciemos si se trata de una toxicodermia o de una erupción vírica. La biopsia suele mostrar tan sólo cambios inespecíficos con discreto infiltrado linfoide perivascular superficial, leve tendencia a la exocitosis, escasa espongiosis y ocasional apoptosis. Únicamente, la presencia de eosinófilos en el infiltrado, nos orientará a favor de toxicodermia. La realización de pruebas epicutáneas de provocación puede ser de ayuda si son positivas, llegando, en ocasiones, a reproducir los hallazgos clinicopatológicos de la toxicodermia original.
Toxicodermias ampollosas
Además de las vesículas producidas cuando existen intensos fenómenos de apoptosis o espongiosis, las toxicodermias pueden causar auténticas lesiones ampollosas con morfología tipo pénfigo, tipo dermatosis IgA lineal o tipo porfiria cutánea tarda. Estas variantes de toxicodermia son muy difíciles de distinguir de sus homólogas no medicamentosas y, tal y como sucede en las lesiones tipo lupus eritematoso, es posible identificar en ellas el patrón de inmunofluorescencia directa característico de la enfermedad en cuestión (IgG intercelular en epidermis de lesiones tipo pénfigo o IgA lineal en las de tipo dermatitis IgA lineal).
La sospecha clínica es fundamental para establecer el diagnóstico de toxicodermia, aunque es difícil dado que a veces las lesiones aparecen un tiempo después de haber iniciado el tratamiento. La mejor manera de confirmar el diagnóstico es conseguir la remisión de las lesiones tras sustituir o retirar el medicamento causal. Microscópicamente, puede sospecharse la etiología medicamentosa cuando el patrón típico de una determinada entidad se combina con otros patrones que son incongruentes en este contexto como por ejemplo, la existencia de daño vasculítico o liquenoide. Además, las lesiones tipo pénfigo por fármacos tienden a tener menos infiltrado inflamatorio que las del pénfigo usual.
Toxicodermias urticariales
La urticaria consiste clínicamente en una tumefacción transitoria de la piel en la que las lesiones individuales no persisten por más de 24 horas. Son una de las formas más frecuentes y conocidas de toxicodermia, aunque no acostumbran a ser biopsiadas, dado que no suelen plantear problemas para el diagnóstico clínico. A primera vista, los cambios microscópicos son mínimos y podría considerarse dentro del grupo de las «dermatosis invisibles». El hallazgo más constante es el edema dérmico, pero éste puede confundirse con el provocado por la infiltración del anestésico. Un rasgo que ayuda a distinguir la falsa imagen edematosa de la anestesia del edema urticarial, es que en el segundo los vasos linfáticos tienden a estar más dilatados y es habitual hallar numerosos mastocitos, algunos parcialmente degranulados, y un número variable de eosinófilos. Es posible que exista infiltrado linfoide perivascular con leve extravasación eritrocitaria pero si la hemorragia perivascular es intensa o se observa tumefacción endotelial o necrosis fibrinoide, deben estudiarse cortes seriados con el fin de descartar una vasculitis urticarial (vasculitis leucocitoclástica con aspecto clínico urticarial). Cuando la urticaria afecta al tejido subcutáneo o a las mucosas se denomina angioedema y reviste una mayor gravedad, especialmente si compromete las vías respiratorias (10).
La terapia fotodinámica, consistente en la aplicación tópica de un medicamento, por ejemplo ácido 5-aminolevulínico, seguida de la exposición a un haz de luz intenso, es una nueva opción terapéutica para el tratamiento de lesiones cancerosas superficiales, pero puede inducir reacciones urticariales severas causadas por el fotocontacto (11).
Toxicodermias vasculíticas
En muchas lesiones causadas por fármacos existe un mayor o menor componente de «vasculitis linfocitaria» con infiltrado linfoide perivascular, tumefacción endotelial y extravasación eritrocitaria que habitualmente se limita a la dermis superficial.
La vasculitis neutrofílica secundaria a fármacos suele afectar a pequeños vasos, adoptando la apariencia microscópica de una vasculitis leucocitoclástica. Suele acompañarse de eosinofilia tisular que, en un estudio reciente, era como promedio de 5 eosinófilos por diez campos de gran aumento, mientras que para los otros tipos de vasculitis leucocitoclástica se encontraba tan sólo un eosinófilo de promedio por cada diez campos de gran aumento (12).
Toxicodermias neutrofílicas
Las reacciones a fármacos caracterizadas por la presencia de neutrófilos constituyen un espectro de lesiones con infiltrado difuso o localizado, que puede llegar a la formación de pústulas o abscesos y que pueden combinarse con vasculitis leucocitoclástica.
La pustulosis exantemática aguda generalizada (AGEP) se caracteriza por la presencia de pústulas espongiformes subcórneas que pueden alcanzar gran tamaño. Se diferencia de la psoriasis pustulosa por la ausencia de hiperplasia psoriasiforme en la epidermis y la presencia de edema en dermis papilar, apoptosis y leve eosinofilia (13).
Los auténticos cuadros tipo psoriasis secundarios a fármacos podrían ser auténticos brotes de psoriasis en pacientes predispuestos. Como rasgos diferenciales únicamente muestran leve eosinofilia y ocasional apoptosis.
Entre las toxicodermias neutrofílicas podemos incluir los cuadros acneiformes (fig. 4), como los que aparecen con cierta frecuencia en pacientes en tratamiento con el recientemente introducido antireceptor del factor de crecimiento epidérmico (anti-EGFR) (14,15). A veces los pacientes desarrollan auténticas foliculitis agudas abscesificadas, especialmente prominentes en las halogenodermias que muestran abscesos de neutrófilos en el interior de folículos hiperplásicos. En las lesiones residuales puede persistir una intensa hiperplasia del epitelio folicular con quistificación y áreas de proliferación epitelial reactiva de aspecto queratoacantomatoso. Se cree que las lesiones halogenodérmicas se producen porque el fármaco (ya sea un halógeno u otro medicamento, como por ejemplo algunos anticonvulsivantes) daña la glándula sebácea, que es la que se inflama en primera instancia, para después extender el proceso a la totalidad del folículo.
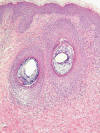
Fig. 4:
Foliculitis acneiforme en un paciente en tratamiento con Iresa®
(antireceptor del factor de crecimiento epidérmico). El infiltrado contiene
linfocitos, neutrófilos y eosinófilos.
Los nuevos tratamientos con factor estimulante del crecimiento de colonias de granulocitos y granulocitos-monocitos (G-CSF y GM-CSF) pueden provocar lesiones tipo síndrome de Sweet con denso infiltrado neutrofílico en dermis. A veces se asocia a una vasculitis necrotizante, dando lugar a cuadros muy espectaculares cuya apariencia clínica e histológica es semejante a un pioderma gangrenoso. En el tratamiento «biológico» con efalizumab (anticuerpo anti LFA-1) puede aparecer una dermatosis papulosa neutrofílica similar al síndrome de Sweet (fig. 5).
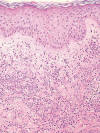
Fig. 5:
Dermatosis neutrofílica en un paciente en tratamiento con Raptiva®
(Efalizumab).
La hidradenitis ecrina neutrofílica podría ser consecuencia de la eliminación de medicamentos irritantes a través del sudor y se observa fundamentalmente en relación con fármacos quimioterápicos. Microscópicamente, existe un denso infiltrado de neutrófilos en la porción excretora de las glándulas ecrinas que puede llegar a destruirlas y dar lugar a abscesos profundos.
Toxicodermia eosinofílica
Aunque la eosinofilia está presente en una gran mayoría de reacciones a fármacos, en algunos pacientes constituye el elemento patológico más evidente, alcanzando un protagonismo especial en la reacción a fármacos con eosinofilia y afectación sistémica mas conocida como, «DRESS», acrónimo en ingles de «Drug Reaction with Eosinophilia and Systemic Symptoms». Este grave síndrome de hipersensibilidad a fármacos es mortal en aproximadamente uno de cada 10 pacientes (16). Suele debutar con fiebre y una erupción cutánea que en su evolución se hace exfoliativa. La gravedad del cuadro viene dada por la afectación sistémica (hepática, renal, miocárdica, pulmonar, pancreática, etc.). Otros hallazgos habituales son adenopatías, edema facial o periorbital y reactivación de la infección por virus herpes tipo 6 (HHV6) y con menor frecuencia citomegalovirus (CMV).
Mucho menos graves son los cuadros de tipo celulitis eosinofílica (síndrome de Wells) que aparecen especialmente por tratamientos sistémicos (fig. 6) o en las zonas de inyección de algunos fármacos como el etanercept o el adalimumab (17,18).
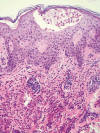
Fig. 6:
Dermatosis eosinofílica tipo enfermedad de Wells.
Alteraciones discrómicas secundarias a la administración de fármacos
Pueden ser de tipo melánico o causadas por el depósito directo del fármaco o sus metabolitos. Las hiperpigmentaciones melánicas, como las que aparecen en relación con tratamientos hormonales, algunos quimioterápicos y fenotiazinas son probablemente las más habituales. El cuadro histológico se limita a un incremento del contenido de melanina en los queratinocitos basales, sin que aumente el número de melanocitos ni existan macromelanosomas. Si el cuadro es poco evidente, o existen dudas sobre el origen del pigmento, puede realizarse una tinción de Fontana para melanina. Las hipopigmentaciones melánicas producen una reducción en el contenido de pigmento melánico de la epidermis que, eventualmente, se asocia a leves cambios inflamatorios, son un efecto secundario característico de los inhibidores de la tirosin cinasa (19).
En las biopsias de lesiones hiperpigmentadas por depósito del fármaco o sus metabolitos, los hallazgos dependen del medicamento. Por ejemplo, el oro se deposita en histiocitos y células fusiformes dérmicas. Las sales de plata se identifican como gránulos negruzcos en histiocitos, fibroblastos, células epiteliales de glándula sudorípara y membrana basal perianexial e incluso en el músculo arrector pilar. El mercurio tiene tropismo por las fibras elásticas, mientras que en la hiperpigmentación por amiodarona aparecen unas «células granulares» de tipo histiocitario dispersas en dermis. Estas células son PAS positivas y contienen un material grisáceo que al microscopio electrónico corresponde a lisosomas complejos (cuerpos mielinoides o con bandas tipo cebra), que parecen ser resultado del metabolismo del fármaco.
Toxicodermias con lesión en dermis y/o panículo
Se trata a menudo de lesiones esclerodermiformes y necrotizantes, habitualmente en relación directa con la inyección local de un fármaco o producto cosmético, aunque también puede tratarse de un proceso a distancia como el eritema nudoso que aparece en relación con tratamientos con sulfonas o anticonceptivos orales. También es bien conocida la necrosis secundaria a la administración de cumarínicos que afecta fundamentalmente a las áreas más ricas en grasa de mujeres de edad media o avanzada (nalgas, abdomen, mamas y muslos. En la biopsia se observa trombosis vascular con necrosis epidérmica y un infiltrado inflamatorio variable.
Los complejos vitamínicos, heparinas, algunos quimioterápicos y citocinas como el interferón pueden producir esclerosis morfeiforme del colágeno en la zona de inyección, sin particularidades microscópicas que permitan diferenciarlas de las auténticas morfeas. Los corticoides tienden a producir atrofia dermoepidérmica y lipodistrofia (20). La extravasación de agentes citostáticos provoca una paniculitis severa en el área afectada (21) que llega incluso a producir necrosis cutánea, pudiéndose asociar a trombosis vascular, pero suele tener una mínima respuesta inflamatoria, dejando tras su curación cicatrices fibrosas. En el campo de la medicina cosmética, la inyección de materiales de relleno cosmético y, con menor frecuencia de substancias «lipolíticas» (22), pueden causar cuadros paniculíticos y necrotizantes, tanto por mecanismos inmunológicos como por sobreinfección. Es especialmente llamativa desde el punto de vista microscópico la necrosis grasa de los autoimplantes (fig. 7), generalmente faciales, a partir de grasa obtenida de una parte del cuerpo en la que es abundante (abdomen o glúteos). En ausencia de información clínica, estas biopsias pueden ser extraordinariamente difíciles de diagnosticar.
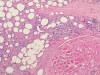
Fig. 7:
Necrosis del tejido graso de un implante autólogo. Las vacuolas de grasa en el
tejido adyacente y la fibrosis intersticial hacen difícil reconocer que la grasa
fue inyectada y no es de ésta localización.
Toxicodermias pseudotumorales
Algunos fármacos son capaces de inducir erupciones pseudolinfomatosas, incluso acompañadas de sintomatología sistémica y esplenomegalia. El prototipo de esta variante de toxicodermia sería el pseudolinfoma por hipersensibilidad a la difenilhidantoína, aunque también se ha descrito en relación con tiazidas, d-penicilamina, antiarrítmicos y diversos barbitúricos. Microscópicamente se observa un infiltrado dermoepidérmico de células mononucleares atípicas, acompañado de numerosos eosinófilos. Algunos fármacos se asocian a cuadros linfoproliferativos CD30+ que únicamente se diferencian de los auténticos linfomas porque remiten tras la retirada del medicamento (23). En pacientes tratados con quimioterapia, al igual que los que reciben formas recombinantes de GM-CSF y G-CSF, se pueden producir infiltrados de histiocitos grandes y de núcleos prominentes, que pueden plantear dudas sobre su naturaleza benigna, especialmente si existe el antecedente de una leucemia.
Los nódulos queratoacantomatosos de algunas halogenodermias pueden simular carcinomas escamosos. La dismaduración epidérmica provocada por antineoplásicos puede mostrar pleomorfismo e hipercromasia nuclear de apariencia Bowenoide (fig. 3) (9). Se ha descrito hiperplasia glandular sebácea (24) en pacientes en tratamiento con ciclosporina.
Algunos fármacos tienen un efecto angiogénico e inducen proliferaciones vasculares como las de tipo granuloma piogénico asociadas a anticonceptivos orales y proliferaciones de tejido de granulación en relación con la administración sistémica de isotretinoína, etretinato o indinavir.
Toxicodermias granulomatosas
Las dermatitis granulomatosas en respuesta a los tratamientos farmacológicos son relativamente raras pero cada vez mejor conocidas y su frecuencia es creciente en relación con los nuevos procedimientos cosméticos.
La inyección de citocinas, entre otros medicamentos, puede causar cuadros granulomatosos con elastofagocitosis localizada. En la biopsia se identifican histiocitos multinucleados que contienen restos de fibras elásticas en su interior o están en vías de fagocitarlas. Las tinciones para fibras elásticas sólo permiten confirmar la pérdida de éstas, puesto que con frecuencia no tiñen los restos de fibras elásticas en el interior de los histiocitos, que han perdido sus cualidades tintoriales. También se han registrado casos de elastofagocitosis generalizada de causa medicamentosa que dan al paciente un aspecto envejecido.
Se han descrito granulomas tipo sarcoide en zonas de tatuaje cosmético (contorno de labios, etc.), por efecto estimulador del interferón y, de manera excepcional, por inyección de toxina botulínica (25). En este último caso, los granulomas fueron reproducidos en el paciente tras la inyección de la toxina en otra localización, pero no con suero salino, lo que hace pensar que se trata de un auténtico fenómeno de estimulación antigénica y no del típico fenómeno de sarcoidosis localizada sobre cicatrices.
La reacción granulomatosa intersticial por fármacos es una llamativa dermatosis caracterizada por la aparición de placas violáceas, a veces anulares, predominantemente en la cara interna de extremidades y en pliegues. Al examen microscópico la distribución del infiltrado histiocitario y la presencia de mucina recuerdan a un granuloma anular de tipo difuso, en fase incipiente (fig. 8). Se diferencian de éste porque la alteración textural y tintorial del colágeno que define la necrobiosis y la fragmentación de fibras elásticas suelen ser menos evidentes y, por otro lado, pueden mostrar daño en la interfase dermoepidérmica, con linfocitos de aspecto activado y algunos neutrófilos o eosinófilos que no son habituales en el granuloma anular.
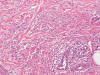
Fig. 8:
Infiltrado intersticial compuesto por histiocitos epitelioides y numerosos
eosinófilos en una reacción granulomatosa intersticial por fármacos.
Las reacciones granulomatosas por implantes cosméticos son, junto con las infecciones, las principales complicaciones de estos procedimientos. Mientras que las infecciones son hasta cierto punto evitables e independientes del tipo de sustancia inyectada, las reacciones granulomatosas parecen ser el tributo ineludible en un porcentaje de casos que varía enormemente dependiendo del material de relleno (26). El mercado de éstas substancias se encuentra en continua expansión por la aparición de nuevos productos que intentan ofrecer resultados duraderos, alternativos a la cirugía intervencionista, y escasos efectos secundarios La experiencia de los últimos años indica que, a la larga, ningún producto se libra de eventuales complicaciones aunque son muy raras en implantes autólogos y mucho más frecuentes en implantes permanentes (no biodegradables), como la silicona. Su base inmunológica suele ser una reacción de tipo IV o tipo retardado. Sin embargo, se ha sugerido la posibilidad de que el ácido hialurónico sea capaz de generar una respuesta mediada por anticuerpos (27).
Pese a que las reacciones granulomatosas tipo cuerpo extraño por implantes cosméticos suelen localizarse en el lugar de inyección, el material inyectado puede migrar y la reacción producirse a una considerable distancia del lugar de implantación, complicando más si cabe el diagnóstico. Con el paso del tiempo, el número de histiocitos disminuye, los fibroblastos sintetizan colágeno de tipo cicatrizal y se produce esclerosis.
La presencia de restos de la sustancia inyectada en el seno de los granulomas o en el interior de macrófagos constituye el rasgo diferencial entre los distintos tipos de implante (28) y tiene por tanto valor pronóstico, terapéutico e incluso, en algunos casos, implicaciones legales (cuando el implante no corresponde al que se le dijo al paciente).
Los implantes de silicona dan infiltrados de histiocitos predominantemente mononucleados con múltiples vacuolas de tamaño variable que pueden contener muy escaso material refringente, dado que se pierde una gran parte durante el procesamiento histológico (fig 9); también pueden observarse espacios quísticos rodeados de histiocitos similares a lipogranulomas. El ácido hialurónico se ve como un material amorfo, basófilo, de aspecto «mixoide» que recuerda al de un cistadenoma mucinoso pero con un tono azulado (fig. 9). Su aspecto es parecido al del hidrogel de poliacrilamida, pero éste tiende a contener múltiples vacuolas en su interior (fig. 10). El colágeno bovino o porcino aparece como masas de colágeno grueso que puede tener aspecto «necrobiótico» y polariza diferente del humano, cuando se desarrolla la respuesta granulomatosa se asemeja a un granuloma anular. En las infiltraciones por Artecoll® se identifican inmunerables espacios perfectamente redondos y de tamaño regular. También son redondas las de Reviderm® (microesferas de dextrano), Evolution® (microesferas de polivinilhidróxidosuspendidas en acrilamida) o Radiance® (microesferas de hidroxiapatita cálcica), mientras que las partículas de Dermalive® y Dermadeep® son poligonales y, las de bioplástico, polilobuladas (fig. 11). No obstante, la tarea de reconocer la sustancia inyectada puede ser complicada y, ante un proceso judicial, puede ser necesaria la colaboración de técnicas para identificación de materiales. Además, no es raro hallar en una misma biopsia diferentes tipos de implante que pueden corresponder a distintas intervenciones separadas incluso por periodos de años (fig. 9). Precisamente, la combinación de diferentes materiales de relleno en una misma localización está contraindicada, por su tendencia a causar complicaciones.
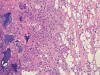
Fig. 9:
Reacción a implante cosmético mixto. A la izquierda se observan histiocitos
multinucleados, tipo cuerpo extraño, rodeando «lagos» de ácido hialurónico. A la
derecha, se identifica la inflamación granulomatosa generada por la silicona que
le había sido implantada hacía años en esta misma localización.
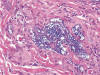
Fig. 10:
Histiocitos multinucleados rodeando a gel de poliacrilamida (Outline®)
que aparece como un material mixoide microvacuolado.
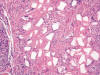
Fig. 11:
Reacción granulomatosa tipo cuerpo extraño rodeando partículas poligonales en
una paciente a la que se inyectó Dermalive.
CONCLUSIÓN
Las reacciones a fármacos o cosméticos son procesos cada vez más frecuentes y, aunque suele tratarse de trastornos leves y autolimitados, pueden llegar a poner en peligro la vida del paciente. La biopsia cutánea es un elemento que contribuye a su diagnóstico y permite, además, reconocer el patrón de respuesta. De esta manera, además de la retirada del fármaco, será posible efectuar un tratamiento específico.
La continua aparición de nuevos medicamentos, la rápida introducción de tratamientos cosméticos cada vez más «agresivos» y la variabilidad de presentaciones clínicopatológicas de las toxicodermias (16), obliga a tener siempre en mente esta posibilidad, especialmente si nos hallamos ante un cuadro microscópico inhabitual o si en el seno de la biopsia identificamos un material extraño.
BIBLIOGRAFÍA
Lammintausta K, Kortekangas-Savolainen O. The usefulness of skin tests to prove drug hypersensitivity. Br J Dermatol 2005; 152: 968-74.
Bronnimann M, Yawalkar N. Histopathology of drug-induced exanthems: is there a role in diagnosis of drug allergy? Curr Opin Allergy Clin Immunol 2005; 5: 317-21.
Yawalkar N. Drug-induced exanthems. Toxicology 2005; 209: 131-4.
Hertl-Yazdi MS, Hertl M. Bullous drug reactions. Hautarzt 2005; 56: 16-23.
Zohdi-Mofid M, Horn TD. Acrosyringeal concentration of necrotic keratinocytes in erythema multiforme: a clue to drug etiology. Clinicopathologic review of 29 cases. J Cutan Pathol 1997; 24: 235-40.
Sehgal VN, Srivastava G. Toxic epidermal necrolysis (TEN) Lyell’s syndrome. J Dermatolog Treat 2005; 16: 278-86.
Callen JP. Drug-induced cutaneous lupus eritematosas, a distinct syndrome that is frequently underecognized. J Am Acad Dermatol 2001; 45: 315-6.
Amerio P, Innocente C, Feliciani C, Angelucci D, Gambi D, Tulli A. Drug-induced cutaneous lupus erythematosus after 5 years of treatment with carbamazepine. Eur J Dermatol 2006; 16: 281-3.
Cady FM, Kneuper-Hall R, Metcalf JS. Histologic patterns of polyethylene glycol-liposomal doxorubicin-related cutaneous eruptions. Am J Dermatopathol 2006; 28: 168-72.
Tan EK, Grattan CE. Drug-induced urticaria. Expert Opin Drug Saf 2004; 3: 471-84.
Yokoyama S, Nakano H, Nishizawa A, Kaneko T, Harada K, Hanada K. A case of photocontact urticaria induced by photodynamic therapy with topical 5-aminolaevulinic acid. J Dermatol 2005; 32: 843-7.
Bahrami S, Malone JC, Webb KG, Callen JP. Tissue eosinophilia as an indicator of drug-induced cutaneous small-vessel vasculitis. Arch Dermatol 2006; 142: 155-61.
Sidoroff A, Halevy S, Bavinck JNB, Vaillant L, Roujeau JC, Acute generalized exantematous pustulosis (AGEP). A clinical reaction pattern. J Cutan Pathol 2001; 28: 113-9.
Sipples R. Common side effects of anti-EGFR therapy: acneiform rash. Semin Oncol Nurs 2006; 22(Suppl): 28-34.
Vallbohmer D, Lenz HJ. Epidermal growth factor receptor as a target for chemotherapy. Clin Colorectal Cancer 2005; 5 Suppl: S19-27.
Roujeau JC. Clinical heterogeneity of drug hypersensitivity. Toxicology 2005; 209: 123-9.
Winfield H, Lain E, Horn T, Hoskyn J. Eosinophilic cellulites-like reaction to subcutaneous etanercept injection. Arch Dermatol 2006; 142: 218-20.
Boura P, Sarantopoulos A, Lefaki I, Skendros P, Papadopoulos P. Eosinophilic cellulitis (Wells’ syndrome) as a cutaneous reaction to the administration of adalimumab. Ann Rheum Dis 2006; 65: 839-40.
Passeron T, Ortonne JP. What’s new in hypochromy. J Dermatolog Treat 2006; 17: 70-3.
Flagothier C, Pierard GE, Quatresooz P. Cutaneous myospherulosis and membranous lipodystrophy: extensive presentation in a patient with severe steroid-induced dermal atrophy. J Eur Acad Dermatol Venereol 2006; 20: 457-60.
Alfaro-Rubio A, Sanmartin O, Requena C, et al. Extravasation of cytostatic agents: a serious complication of oncological treatment. Actas Dermosifiliogr 2006; 97: 169-76.
Rotunda AM, Kolodney MS. Mesotherapy and phosphatidylcholine injections: historical clarification and review. Dermatol Surg 2006; 32: 465-80.
Kempf W. CD30+ lymphoproliferative disorders: histopathology, differential diagnosis, new variants, and simulators. J Cutan Pathol 2006; 33 Suppl: S58-70.
Engel F, Ellero B, Woehl-Jaegle ML, Cribier B. Diffuse sebaceous hyperplasia of the face induced by cyclosporine. Ann Dermatol Venereol 2005; 132: 342-5.
Ahbib S, Lachapelle JM, Marot L. Sarcoidal granulomas following injections of botulic toxin A (Botox) for corrections of wrinkles] Ann Dermatol Venereol 2006; 133: 43-5.
Andre P, Lowe NJ, Parc A, Clerici TH, Zimmermann U. Adverse reactions to dermal fillers: a review of European experiences. J Cosmet Laser Ther 2005; 7: 171-6.
Micheels P. Human anti-hyaluronic acid antibodies: is it possible? Dermatol Surg 2001; 27: 185-91.
Requena C, Izquierdo MJ, Navarro M et al. Adverse reactions to injectable aesthetic microimplants. Am J Dermatopath 2001; 23: 197-202.