
Vol. 40, n.º 1, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 1, 2007 |
REVISIONES
Sergio Piña-Oviedo1,2, Carlos Ortiz-Hidalgo1,3
1 Laboratorio de Biología Celular y
Tisular. Escuela de Medicina. Universidad Panamericana. Donatello 59. Colonia
Insurgentes Mixcoac. C.P. 03920, México D.F., México.
2 Instituto de Hematopatología «The Anton van Leeukwenhoek Society»
for Life & Exact Sciences. Tamaulipas 131. Colonia Cuajimalpa. C.P. 0500,
México, D.F. México.
3 Departamento de Patología. Hospital ABC. Sur 132. No. 116. Colonia
Las Américas. C.P. 01120. México D.F., México.
cortiz@abchospital.com
RESUMEN
La neoplasia hematodérmica CD4+/CD56+ es un tumor poco frecuente que se presenta en adultos con un curso clínico desfavorable. El cuadro inicial se manifiesta por afección cutánea y posteriormente evoluciona a una enfermedad extracutánea generalizada. Histológicamente, la neoplasia hematodérmica CD4+/CD56+ se caracteriza por la presencia de células neoplásicas que infiltran dermis y tejido celular subcutáneo, sin afectar la capa epidérmica. El infiltrado neoplásico es homogéneo y las células presentan apariencia de blastos. El inmunofenotipo CD4+/CD56+ es característico e indispensable para el diagnóstico diferencial entre otros linfomas/leucemias cutáneos. La neoplasia hematodérmica CD4+/CD56+ es originada de la célula dendrítica plasmocitoide, de origen hematopoyético. Característicamente, las células dendríticas plasmocitoides expresan el receptor a de IL-3 (CD123) en su superficie y carecen de marcadores de estirpe mieloide y linfoide. Su función consiste en establecer un mecanismo de regulación entre la respuesta inmunológica innata y específica, ser células presentadoras de antígenos, elaborar citocinas inflamatorias y, posiblemente, regular procesos de tolerancia inmunológica. La patología y disfunción de las células dendríticas plasmocitoides es importante para tratar de explicar procesos autoinmunes, procesos infecciosos virales y la pérdida de tolerancia inmunológica en cierto tipo de tumores.
Palabras clave: Neoplasia hematodérmica CD4+/CD56+, linfoma cutáneo NK blástico, célula dendrítica plasmocitoide, receptor a de interleucina-3, CD123.
SUMMARY
CD4+/CD56+ Hematodermic Neoplasm is an uncommon tumor found in the adult population and generally evolves with a poor clinical outcome. The presence of cutaneous involvement at the beginning of the disease, followed by an extracutaneous generalized phase is characteristic. Histologically, the CD4+/CD56+ Hematodermic Neoplasm features a nonepidermotropic, dermal and subdermal infiltration of cells which resemble lymphoblasts or myeloblasts. The CD4+/CD56+ immunophenotype not only is characteristic, but also a very important tool in the differential diagnosis between other cutaneous lymphoid/myeloid neoplasms. Recently, the hematopoietic-derived plasmacytoid dendritic cell has been related to the CD4+/CD56+ hematodermic neoplasm origin. Typically, the plasmacytoid dendritic cells express the surface marker IL-3 receptor a (CD123) and lack of myeloid and lymphoid antigens. Functionally, plasmacytoid dendritic cells are implicated in the regulation of innate and adaptive cell immunity, antigen processing, production of inflammatory cytokines and probably, the association with lymphoid-organ tolerogenic responses. Understanding plasmacytoid dendritic cell dysfunction is important for its implication in several pathologic conditions such as autoimmune disorders, viral infections and loss of tolerance response in some tumors.
Key words: CD4+/CD56+ hematodermic neoplasm, blastic NK-cell lymphoma, plasmacytoid dendritic cell, IL-3 receptor alpha, CD123.
INTRODUCCIÓN
En 1995, Brody et al. describieron el caso de un paciente masculino de 63 años quien presentó un cuadro clínico caracterizado por fiebre, nódulos subcutáneos, hipertrofia gingival, crecimiento de la glándula lacrimal, anemia, trombocitopenia, y la presencia de células leucémicas en sangre periférica y médula ósea (1). El paciente no respondió de manera favorable al tratamiento quimioterapéutico y falleció 6 meses después del diagnóstico. Posterior al estudio histológico y molecular de las células neoplásicas, se concluyó que éstas últimas eran células de estirpe NK («natural killer») con morfología e inmunofenotipo inusual, ya que presentaban aspecto monocitoide, citoplasma agranular y el inmunofenotipo CD3-/CD4+/CD56+/CD15+. Debido a todas estas características, la enfermedad fue llamada «leucemia aguda NK CD4+ agranular» (1). Después de esta primera descripción, han sido informados múltiples casos con características similares, y cada autor ha propuesto una diferente nomenclatura para este tipo de neoplasia, entre las que destacan «leucemia/linfoma blástico NK» (2), «linfoma CD4+ CD56+» (3) y «neoplasia hematodérmica agranular CD4+ CD56+» (4).
El origen de esta neoplasia se mantuvo en dilema por algunos años (1-6), y no fue hasta el año 2001 que se logró identificar a la célula dendrítica plasmocitoide (CDP) o célula dendrítica tipo 2 (DC2) de origen hematopoyético, como la célula precursora de esta neoplasia (7). Actualmente se ha considerado a esta patología como una «neoplasia hematopoyética maligna CD4+ CD56+ de linaje negativo» (8,9), ya que dentro de su inmunofenotipo, no existe la expresión de marcadores de origen mieloide o linfoide, a excepción de unos cuántos (vide infra). En 2003 Jacob et al., basados en un extenso estudio de las características inmunofenotípicas, morfológicas y funcionales de las CDPs neoplásicas, no sólo propusieron denominar a esta entidad como «leucemia/ linfoma de CDPs inmaduras», sino que también describieron de manera general el cuadro clínico de esta última (9).
En la nueva clasificación para linfomas cutáneos de la Organización Mundial de la Salud (OMS) del año 2005, el nombre de «neoplasia hematodérmica CD4+ CD56+» ha sido conservado (10). Recientemente, algunos autores han sugerido llamar también a esta neoplasia como «DC2oma», a consecuencia de su origen en CDPs.
Para fines de esta revisión, manejaremos el nombre de «neoplasia hematodérmica CD4+/CD56+» (NH) para hacer referencia a este tumor agresivo de descripción reciente.
MANIFESTACIONES CLÍNICAS
La NH es un tumor poco frecuente que se presenta en adultos, aunque existen algunos casos descritos en niños (9). Afecta predominantemente a hombres, presenta un curso clínico desfavorable (9-12) e independientemente del tratamiento, el tiempo promedio de sobrevida es de 14 meses (13). Inicialmente, la NH puede caracterizarse por afección cutánea con presencia de nódulos únicos o múltiples, que afectan predominantemente tórax y/o extremidades. Las lesiones nodulares suelen ser eritematosas o violáceas, presentar descamación fina y en algunas ocasiones pueden estar ulceradas (9,14) (fig. 1). En unos cuantos meses —tiempo aún no bien definido—, la mayoría de los casos evolucionan a la enfermedad extracutánea generalizada, que se caracteriza por la aparición de linfadenopatías, hepato y/o esplenomegalia e infiltración de médula ósea, pero cualquier órgano o tejido puede finalmente encontrarse afectado (4,10,11,14-16). En un informe clínico de 63 pacientes con NH —probablemente el más extenso que se conoce hasta el momento—, la infiltración a médula ósea se documentó en 46% de los casos como cuadro inicial y en 72% durante el curso de la enfermedad. Además, en ese mismo estudio, la ausencia de afección extracutánea y edad de presentación menor a 40 años, fueron definidos como factores de buen pronóstico (11).
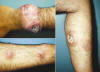
Fig. 1:
Características clínicas de la NH. Paciente de 36 años quien acudió a consulta
por la aparición de nódulos cutáneos eritematosos (entre 1 y 5 cm de diámetro
aproximadamente), acompañados de sensación de ardor y prurito, distribuídos
predominantemente en tórax y extremidades. Una biopsia previa de las lesiones
fue reportada como una leucemia/linfoma infiltrante a piel. Posteriormente, una
segunda biopsia y el resultado de la inmunohistoquímica permitieron diagnosticar
a esta entidad como NH. Fotografías de las lesiones en la muñeca (izquierda,
imagen superior), la región del antebrazo (izquierda, imagen inferior) y en la
cara lateral de la pierna (derecha).
En algunos casos, se ha informado la aparición de NH posterior a la presencia de otros tumores hematológicos como el linfoma folicular y la mielodisplasia de bajo grado (17) y, en raras ocasiones, la misma NH puede progresar a un cuadro franco de leucemia aguda mieloide (18).
CARACTERÍSTICAS MICROSCÓPICAS
Histopatología
La afección cutánea de la NH se caracteriza por la presencia de células neoplásicas que infiltran toda la dermis hasta el tejido celular subcutáneo sin afectar la capa epidérmica, formando una zona de Grenz (5,8,10). Generalmente no hay necrosis y ocasionalmente puede encontrarse patrón angiocéntrico y reacción desmoplásica acentuada en la dermis papilar y reticular (5) (fig. 2). El infiltrado tumoral es homogéneo, constituido por células neoplásicas de aspecto monótono, con mitosis ocasionales y sin infiltrado de células reactivas como neutrófilos o mastocitos. Hay casos informados de NH en donde las células tumorales se distribuyen formando pseudorrosetas de Homer-Wright (19,20). A mayor detalle, las células neoplásicas presentan núcleo de tamaño mediano, redondo u oval, con cromatina finamente granular y en ocasiones nucleólos pequeños (fig. 3, izquierda). Todas las características anteriores brindan a esta neoplasia apariencia «blástica», por lo que no es de extrañar que las células de la NH se puedan confundir (por morfología exclusiva) con linfoblastos o mieloblastos (5,10). El citoplasma de estas células suele ser basófilo y no muy abundante. Sin embargo, en frotis sanguíneos, improntas de los tejidos afectados o zonas de tumor poco compactas, las células suelen observarse con núcleo excéntrico, imagen negativa del aparato de Golgi, microvacuolas y ocasionales prolongaciones citoplásmicas digitiformes (7,8,17,21) (fig. 3, derecha).
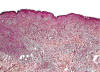
Fig. 2:
Histopatología de la NH. Imagen a bajo aumento de uno de los nódulos cutáneos.
Se observa alteración de la estructura de la dermis y tejido celular subcutáneo,
secundario a la presencia de infiltrado tumoral homogéneo y reacción
desmoplásica severa. No se aprecian áreas de necrosis. La epidermis y una fina
capa de tejido conectivo debajo de la misma (zona de Grenz) no se encuentran
afectadas.
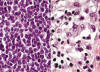
Fig. 3:
Histopatología de la NH. A mayor detalle se observa que el infiltrado tumoral es
homogéneo y está constituido por células con núcleo redondo, cromatina fina y
nucléolos; el citoplasma de las células es escaso y las mitosis son ocasionales.
No hay presencia de células reactivas (izquierda). En las zonas en donde las
células tumorales se encuentran menos compactas, puede apreciarse la morfología
«plasmocitoide» de las mismas. Estas células se caracterizan por presentar
citoplasma basófilo, zona clara del aparato de Golgi y prolongaciones
citoplásmicas (derecha).
Inmunohistoquímica
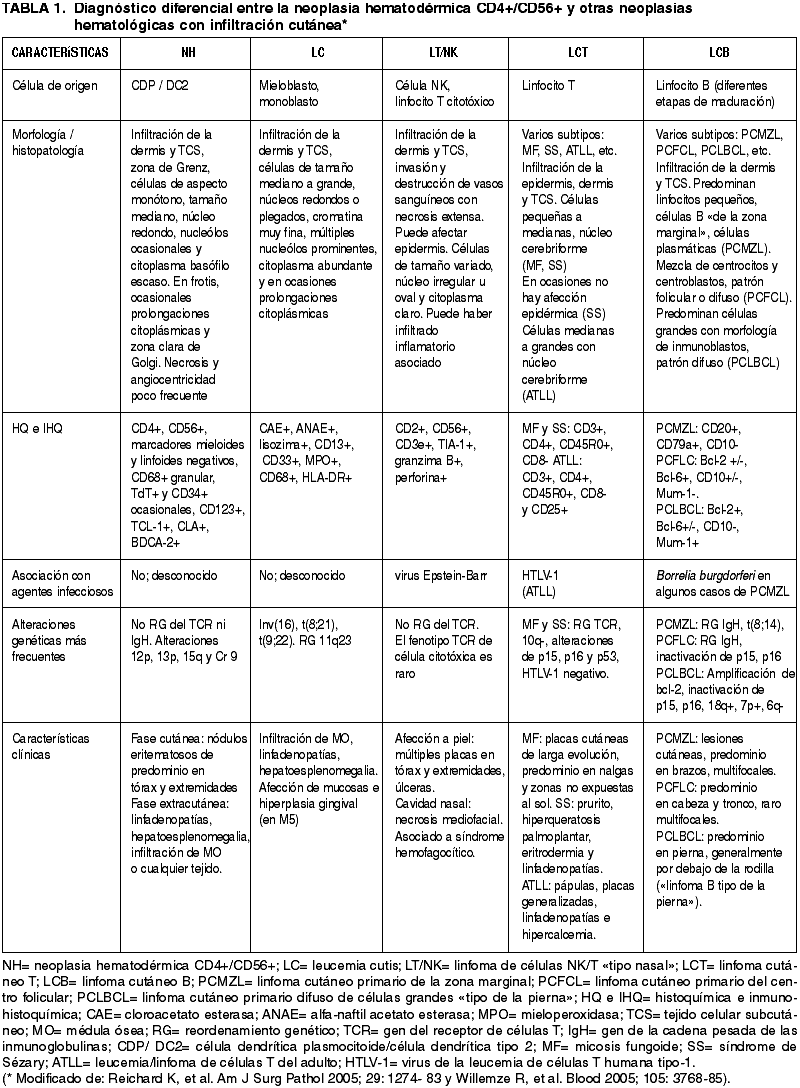
La NH se caracteriza por la expresión de CD4+/CD56+/CD2+/-/CD7+/-/CD45RA+ en el citoplasma de las células tumorales (figs. 4 y 5). Característicamente, los marcadores de estirpe mieloide (CD13, CD33 y mieloperoxidasa) y linfoide (CD3, CD8, CD20) son negativos (4,5,10,12,16), aunque en algunos casos se ha descrito expresión citoplásmica de CD3 (9,18,22-25). El CD68 y el TdT pueden ser positivos; el primero, suele expresarse en un patrón citoplásmico granular (5,18,19) y, el segundo con positividad nuclear, y puede estar asociado a buen pronóstico si el porcentaje de células neoplásicas TdT+ supera el 50% (11) (fig. 5). También, en algunas ocasiones, pueden encontrarse expresión de CD34 (5).
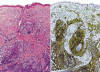
Fig. 4: Inmunohistoquímica. La NH
corresponde a un tumor originado de células dendríticas plasmocitoides. Estas
células que se encuentran infiltrando dermis y tejido celular subcutáneo
(izquierda), característicamente son positivas para el CD4 en la
inmunohistoquímica (derecha).

Fig. 5:
Inmunohistoquímica. Infiltrado de CDPs positivo para CD56 alrededor de un
conducto de glándula sudorípara (izquierda). El CD68 es positivo de manera focal
y, se expresa con un patrón granular fino en el citoplasma de las células
tumorales (derecha, imagen superior). En ocasiones, el TdT puede ser positivo
(derecha, imagen inferior).
Recientemente se han descrito anticuerpos que reconocen a las CDPs, como el CD123 (IL 3 Ra/receptor a de IL-3) (7-10,17,26), el TCL-1 (T-Cell Leukemia/Lymphoma-1) (18,27,28), el CLA (Cutaneous Lymphocyte Associated Antigen) (28) y el BDCA-2 (Blood Dendritic Cell Antigen-2) (26,29). El TCL-1 es un proto-oncogén expresado en algunos linfomas B, linfocitos T «inmaduros» y en casi todos los casos de leucemia prolinfocítica T (30,31). En esta última, el TCL-1 se encuentra sobreexpresado debido a una traslocación que ocurre entre un gen del receptor de células T (TCR) y las regiones cromosómicas 14q32 o Xq28 (32). La función definitiva de este proto-oncogén se desconoce hasta hoy, pero parece ser un factor de transcripción importante relacionado con los mecanismos de proliferación y supervivencia celular. Sin embargo, en condiciones donde las células son cromosómicamente inestables y predispuestas a desarrollar transformación maligna (similar a lo que ocurre con las mutaciones del gen de la ataxia telangiectasia, ATM), la expresión de TCL-1 no parece favorecer el desarrollo de tumores (33). El porcentaje de expresión de este marcador es muy bajo en los linfomas T/NK extraganglionares o de tipo «nasal», en tumores de células T «maduras» y en leucemias mieloides, pero su expresión es constante en la NH, así como en la fase de transformación mielomonocítica de la misma (27).
El CLA parece estar relacionado con el tropismo que presentan las CDPs por la piel, ya que se une a las moléculas de selectina-E de las células endoteliales de capilares de la dermis. La expresión de CLA ha sido descrita en un mayor porcentaje de casos de NH en comparación con la leucemia mielomonocítica localizada a piel y, característicamente, se presenta en una distribución de gránulos finos (28).
El receptor de lectina tipo-C (CLR), BDCA-2, forma parte de la familia de receptores inmunoactivadores de células dendríticas. Además de ser una molécula de adhesión, su función consiste en la captación de señales externas (antígenos, citocinas, etc.) para después traducirlas en respuestas intracelulares, ya sea de activación o inhibición celular (29).
Recientemente se describió el CD123, el cual se expresa específicamente en la superficie de las CDPs normales y neoplásicas, lo cual lo convierte en un marcador muy útil en el diagnóstico de la NH (fig. 6). Su función consiste en brindar protección contra la apoptosis y favorecer la diferenciación y maduración de las CDPs (7,34). En el apartado de célula dendrítica plasmocitoide presentamos una descripción más detallada de las funciones de esta molécula.
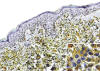
Fig. 6:
Inmunohistoquímica. Como se menciona en el texto, el CD123 es un marcador
específico para CDPs. En esta imagen se observa parte de la dermis papilar con
un infiltrado homogéneo de células CD123 positivas. Nótese como las células
neoplásicas no infiltran la epidermis. En el recuadro de la esquina inferior
derecha, se observa que el CD123 (receptor
a
de IL-3) se localiza preferentemente en el citoplasma de las CDPs neoplásicas.
Todos estos anticuerpos son útiles para el diagnóstico diferencial de la NH con otras neoplasias cutáneas de origen hematológico como el linfoma cutáneo de células T/NK CD56+, el linfoma primario cutáneo de células T o B, y la infiltración leucémica de la piel, generalmente asociada a leucemia mielomonocítica (10,11). La tabla 1 muestra de manera detallada el diagnóstico diferencial entre la NH y otras neoplasias hematológicas cutáneas.
Citogenética
Las alteraciones genéticas observadas en la NH, hasta hoy, son totalmente inespecíficas y pueden abarcar regiones muy grandes del genoma. Muchos de los reordenamientos genéticos encontrados en una misma CDP pueden observarse en diversas neoplasias mieloides y linfoides (35). Desde el primer informe realizado por Brody et al., se han identificado diversas anomalías cromosómicas en las CDPs neoplásicas como cariotipos anormales (44XY, 45XY), 13q+, deleción de 5q y de los cromosomas 13 y 15 (1,4). Otras aberraciones cromosómicas recientemente identificadas incluyen deleciones de 6q, 12p, 13q, 15q y cromosoma 9 (17,35), así como deleciones y ganancias cromosómicas en la región 12p13 (17) que contiene al gen TEL, implicado en la patogénesis de algunas leucemias agudas (35). Sin embargo, esta alteración sólo se ha encontrado en unos cuantos casos de NH (17). Se espera que en el futuro, nuevos estudios moleculares puedan relacionar la presencia de una o varias alteraciones genéticas con la génesis tumoral de la NH.
Es de interés que, a pesar de que raramente puede expresarse el antígeno CD3 en la NH y, que todos los casos característicamente expresan CD4, no se han identificado reordenamientos de los genes del TCR. De la misma forma, no se han documentado reordenamientos de los genes de las cadenas pesadas de las inmunoglobulinas (IgH) (1,6,17,20). A pesar de que el desarrollo de algunas neoplasias hematológicas se encuentra asociado con la infección por virus oncogénicos (HTLV-1, etc.), no se ha informado asociación entre la NH e infección por virus de Epstein-Barr (1-3,6,9,17).
Por último, es interesante comentar que han sido descritos algunos casos de NH en los cuales, durante el curso de la enfermedad, el fenotipo de las células neoplásicas puede virar hacia uno de células de estirpe mielomonocítica, volviendo así indistinguible el cuadro clínico y diagnóstico de la NH con el de una leucemia mieloide aguda (18).
LA CÉLULA DENDRÍTICA PLASMOCITOIDE (DC2)
Historia, origen hematopoyético y función
En 1958, los patólogos alemanes Karl Lennert y Wolfgang Remmele describieron por primera vez la presencia de «linfoblastos» con una morfología muy similar a las células plasmáticas (núcleo excéntrico, citoplasma basófilo y una zona clara que corresponde al aparato de Golgi), pero que se encontraban exclusivamente en la paracorteza del ganglio linfático (zona parafolicular o zonas T) y alrededor de las vénulas de endotelio alto (VEA) (36) (figs. 7 y 8). Ultraestructuralmente, se identificó que estas células presentaban heterocromatina marginal, citoplasma con retículo endoplásmico rugoso abundante y cisternas de aparato de Golgi yuxtanuclear (34). Debido a estas características, Lennert y Remmele las llamaron «células plasmáticas asociadas a la zona T» o «células T plasmocitoides» (36-38). En 1988, ya con el uso de anticuerpos monoclonales, Facchetti et al. designaron a estas células «monocitos plasmocitoides», ya que dentro de su inmunofenotipo expresaban los marcadores CD15, CD36 y CD68, los cuáles están relacionados con la línea de diferenciación hacia monocitos/macrófagos (39). Y fue también por esta característica, que se postuló que el origen de estas células era de estirpe monocítica (39).
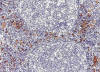
Fig. 7:
Células dentríticas plasmocitoides (CDPs). Las CDPs normales se encuentran en la
zona paracortical (zona parafolicular o zona T) de los tejidos linfáticos,
generalmente asociadas a las VEA. Zona parafolicular de un ganglio linfático
normal. Inmunohistoquímica para CD123.
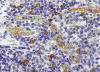
Fig. .8:
Células dentríticas plasmocitoides (CDPs). Mayor detalle de la zona
parafolicular de un ganglio linfático normal. Se observan varias CDPs alrededor
y en la pared de varias VEA. Las CDPs expresan antígenos de superficie que les
permiten migrar a través de las VEA para alcanzar la zona T de los tejidos
linfáticos y llevar a cabo su función inmunoestimuladora y de CPA (ver texto).
Inmunohistoquímica para CD123.
Recientemente, se descubrió que las «células T plasmocitoides» o «monocitos plasmocitoides» corresponden a las CDP o DC2, pertenecientes a la familia de células dendríticas (DC, por sus siglas en inglés) (34,40).
Las DC son células que se originan a partir de precursores hematopoyéticos CD34+. Su función primordial es la presentación de antígenos (CPA), la regulación de la respuesta inmune y, posiblemente, el control de los fenómenos de tolerancia inmunológica (41-43). Las DC constan de 3 subtipos: 1) Las células dendríticas mieloides o DC1, 2) las células dendríticas plasmocitoides o DC2 y, 3) las células del Langerhans (CL). Cada subtipo celular presenta un origen, marcadores de superficie celular y funciones distintas (41-44) (fig. 9). Las células dendríticas foliculares o células de Nossal, no pertenecen a este grupo de DC, y por lo tanto no son descritas en esta revisión.
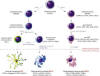
Fig. 9:
Maduración de las células dendríticas (DC). Representación esquemática del
origen y proceso de maduración de las células de Langerhans, las células
dentríticas mieloides (DC1) y plasmocitoides (DC2). Algunas citocinas y
antígenos de superficie han sido omitidos para evitar la confusión del lector.
Nótese que el origen de las DC2 corresponde a una célula precursora linfoide,
sin embargo, estudios recientes han demostrado que estas mismas células pueden
generarse también de precursores mieloides. Es importante mencionar que algunos
de los procesos de maduración mostrados aquí, aún no son completamente
definitivos. (Esquema elaborado por: Sergio Piña-Oviedo, Copyright®).
La DC1 deriva de precursores mieloides y consta de dos subtipos celulares, las células dendríticas de la dermis y las células dendríticas intersticiales. El inmunofenotipo de las DC1 es CD11b+/CD11c+/CD13+/CD33+. Su función principal consiste en la presentación antigénica por medio del complejo de histocompatibilidad tipo II (MHC-II), la producción de IL-12 y es la célula encargada de favorecer una respuesta inmune de tipo Th1 (41,42,44).
La CL —derivada de precursores mieloides dependientes de TGF-b— se encuentra en la epidermis y expresa el inmunofenotipo S-100+/CD1a+/Langerina+/cadherina-E+ (42), así como la presencia ultraestructural de gránulos de Birbeck, que son invaginaciones de membrana citoplásmica en forma de estructuras «raquetoides», características de estas células. Cuando un antígeno es captado por una CL en la piel, ésta migra como «célula velada» hacia las zonas paracorticales de los ganglios linfáticos en donde se transforma en una CPA para linfocitos T (célula dendrítica interdigitante) (41,45).
La DC2 o CDP es la única DC derivada de precursores linfoides (41,42,44). Citocinas como IL-1, IL-7, TNF-a, SCF (stem cell factor) (42), el ligando de FLT-3 (44), y ciertos factores de transcripción como Spi-B (46), entre otros, están involucrados en la diferenciación y compromiso de estos precursores hacia DC (fig. 9). Sin embargo, Yang et al. recientemente obtuvieron CDPs a partir de precursores mieloides, pero éstas presentan características y funciones distintas a las CDPs de origen linfoide, entre ellas, la producción de una mayor cantidad de interferón-a (IFN-a) después de la estimulación con secuencias de nucleótidos similares a las del ADN bacteriano (47).
Las CDPs se encuentran en la dermis, médula ósea y órganos linfoides como timo, ganglio linfático, bazo, amígdalas y placas de Peyer (34,40,44,48). Estas células se originan a partir de células precursoras llamadas pre-CDPs («CDP precursoras», localizadas en sangre periférica, y que corresponden a <1% de las células mononucleares circulantes), las cuales expresan CD4+, carecen de TCR, de cadenas CD3, de marcadores mieloides y linfoides y no producen inmunoglobulinas (44,49,50). La función principal de las pre-CDPs consiste en establecer un mecanismo de regulación entre la respuesta inmunológica innata y específica (44,51). Después de recibir estímulos virales (52), bacterianos (53), parasitarios (54), tumorales o meramente inflamatorios (44), la pre-CDP lleva a cabo modificaciones estructurales y funcionales que favorecen su maduración y migración hacia las zonas de inflamación o hacia las zonas T de los ganglios linfáticos. La captación de antígenos por las pre-CDPs parece estar asociada a los receptores de lectina tipo-C (CLR), como el BDCA-2 (29,44) y, su activación depende de la interacción de antígenos inflamatorios con los receptores «Toll» 7 y 9 (TLR-7, -9) (54-58).
Una vez que las pre-CDPs son activadas, comienzan a expresar antígenos de superficie como el CCR7 (59), CLA (28), ChemR23/chemerina (60), L-selectina y V-CAM (42-44), los cuales les permiten migrar a través de las VEA y capilares de la dermis hacia los tejidos en donde su función es requerida (zona paracortical del ganglio, médula ósea, etc.) (fig. 10). A su vez, las VEA, los capilares de la dermis y los tejidos periféricos pueden producir moléculas como el SDF-1 (Stromal-derived factor-1) (61) y adenosina, que sirven como factores quimiotácticos para la migración de las pre-CDPs a través de ellos (44).
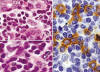
Fig. 10:
Características histológicas finas de las CDPs. En la tinción H&E, las CDPs
presentan un núcleo redondo u oval, de mayor tamaño que el de los linfocitos
circundantes (flechas blancas). Su citoplasma es claro y abundante, con varias
prolongaciones que le dan aspecto «dendrítico» (izquierda, imagen inferior).
Generalmente, las CDPs se encuentran asociadas a VEA (izquierda, imagen
superior). En la inmunomarcación con CD123, las CDPs generalmente se encuentran
formando grupos y, en ocasiones, puede apreciarse también la presencia de
prolongaciones del citoplasma (flecha negra).
Una vez fuera de la circulación, las pre-CDPs inician la producción y secreción de IFN-a y -b, IL-8 y TNF-a, lo que favorece una eficiente activación de linfocitos T y el desarrollo de una respuesta inmune de tipo Th2 con producción de IL-4 e IL-10 (función de célula inmunoestimuladora) (44,62-64). Posteriormente, se lleva a cabo la maduración de pre-CDPs a CDPs, la cual se encuentra regulada por IL-3 y el ligando de CD40 (34). A partir de este momento, las CDPs disminuyen la expresión de moléculas que les permiten migrar y la producción de IFN-a y -b. Además, las CDPs comienzan a expresar CD4, CD40, CD80, CD86, MHC-II en su superficie, así como niveles bajos de antígenos mieloides y, se establecen como células residentes en los tejidos periféricos (función de CPA) (34,42,44). Sin embargo, dependiendo del tipo de estímulo, cantidad de antígeno presente, microambiente celular y estadio de diferenciación de la CDP, la respuesta inmune desencadenada puede ser de predominio Th1 (65,66). Esto último sugiere que las CDPs tienen la capacidad de regular la polaridad de la respuesta inmunológica hacia Th1 o Th2.
Las CDPs también son abundantes en la médula del timo y, al igual que en la paracorteza del ganglio linfático, se encuentran asociadas a las células reticulares interdigitantes (67,68). Esta localización sugiere que las CDPs juegan un papel importante en el desarrollo de tolerancia y selección de linfocitos T. Como apoyo a esta teoría, se ha observado que las CDPs pueden producir anergia de ciertos linfocitos T CD4+ en seres humanos (44) y, en modelos animales, pueden favorecer el desarrollo de linfocitos reguladores T CD8+ productores de IL-10, cuya función consiste en el bloqueo de la activación de células T CD8+ vírgenes (69). También se ha observado que ciertas células con un inmunofenotipo similar al de los precursores de DC2, facilitan el trasplante alogénico de células madre (70) y, en los trasplantes de células sanguíneas obtenidas por estimulación con GM-CSF (que usualmente contienen un gran número de DC), los casos de enfermedad injerto contra huésped son menos severos (71).
Disfunción y alteraciones de la CDP
La mayoría de las alteraciones de las CDPs están relacionadas con el desarrollo de una respuesta inmunológica inadecuada. Al funcionar como células reguladoras de la respuesta inmune innata y específica, la disfunción de las CDPs parece estar implicada en el desarrollo de algunas enfermedades autoinmunes (lupus eritematoso y psoriasis), enfermedades alérgicas (dermatitis de contacto) y en el rechazo de trasplantes (44). Asimismo, se ha documentado la presencia de CDPs en la enfermedad de Kikuchi-Fujimoto, la hiperplasia linfoide de la piel (72), la infiltración linfocítica de Jessner (73) y en el parénquima de algunos tumores como melanomas (74,75), tumores de cabeza y cuello (76) y síndromes mieloproliferativos (77). Curiosamente, las DC2 encontradas dentro de los tejidos tumorales no desarrollan la capacidad de producir IFN-a, lo que sugiere que estas células son CDPs «maduras», o bien, pre-CDPs que presentan una alteración funcional (61). Por otro lado, parece que las células tumorales son las encargadas de atraer a las DC2 y volverlas disfuncionales, con la finalidad de inhibir el desarrollo de una respuesta inmune adecuada en su contra, lo cual favorece el desarrollo y progresión del tumor (44,61).
Las DC (DC1 y DC2) tienen la función primordial de presentar antígenos y son esenciales para activar la respuesta inmune en contra de diversos virus, entre ellos el virus de la inmunodeficiencia humana tipo-1 (VIH-1) (44,78). Sin embargo, cuando existe infección (aguda o crónica) por VIH-1, conforme la carga viral aumenta, la cantidad de DC disminuye progresivamente, proceso que sólo puede revertirse parcialmente con la terapia antiretroviral (79-83). En la infección crónica por VIH-1, las CDPs se vuelven disfuncionales y disminuyen la producción de IFN-a, por lo tanto, no pueden llevar a cabo la activación de linfocitos T y favorecen el desarrollo de infecciones por patógenos oportunistas (84). De igual forma, las DC1 y DC2 pueden infectarse con el virus, operar de manera anormal y favorecer la infección de linfocitos T CD4+ por VIH-1 (78).
Expresión de CD123
El CD123 (IL-3 Ra) es una proteína que se encuentra sobreexpresada en células hematopoyéticas normales que se encuentran en etapa de proliferación, y también ha sido identificada en neoplasias de origen hematopoyético como la leucemia mieloide aguda (85), la leucemia aguda linfoblástica-B (86) y la leucemia de células peludas (86,87). Las CDPs normales y neoplásicas característicamente expresan el CD123 en su superficie, lo que les confiere protección contra la apoptosis y la capacidad de diferenciarse y madurar; esto les permite migrar y llevar a cabo sus funciones en diversos órganos (7,34).
La IL-3 es una citocina implicada en la proliferación, diferenciación y protección contra la apoptosis de diversas células precursoras hematopoyéticas. Después de su unión al receptor de IL-3, su función consiste en activar la vía intracelular de JAK/STAT, cuyos factores de transcripción accionan genes implicados en el mecanismo de replicación celular (88). La especificidad del CD123 por las CDPs sugiere la utilización de este marcador como un nuevo recurso para el diagnóstico de la NH, así como también la posibilidad de un nuevo abordaje terapéutico a base de anticuerpos específicos contra el CD123. Lo anterior ya ha sido postulado por algunos investigadores (89).
CONCLUSIÓN
La neoplasia hematodérmica CD4+/CD56+ es un tumor recientemente descrito, que toma origen en las CDPs (DC2). Es importante conocer su existencia, debido al amplio diagnóstico diferencial que existe con otras variedades de leucemias y linfomas que infiltran piel. Además de las características clínicas e histológicas, la inmunomarcación CD4+/CD56+, la ausencia de marcadores de estirpe mieloide y linfoide y, la expresión de nuevos marcadores específicos de CDPs como el CD123 (IL-3 Ra), son criterios útiles para establecer un diagnóstico adecuado. El origen y patogénesis de esta neoplasia apenas están empezando a esclarecerse, pero aún quedan muchas incógnitas respecto a la función de las CDPs normales y su contraparte neoplásica por resolver.
AGRADECIMIENTOS
Agradecemos al Dr. Héctor Herrera del Hospital General de Culiacán, Sinaloa, México y al Dr. Heliodoro Coronado del Hospital Aranda de la Parra, León, Guanajuato, México, por permitirnos incorporar imágenes clínicas e histológicas de sus casos para la revisión de este artículo. Además extendemos los agradecimientos al Dr. Alfonso Heras, de BioSB, E.U., por la donación del anticuerpo anti-CD123 y al Sr. José E. Torres, de la sección de inmunohistoquímica del departamento de Patología del Hospital ABC, por la realización del material histológico e inmunohistoquímico.
BIBLIOGRAFÍA
Brody J, Allen S, Schulman P, Sun T, Chan W, Friedman H, et al. Acute agranular CD4-positive natural killer cell leukemia. Comprehensive clinicopathologic studies including virologic and in vitro culture with inducting agents. Cancer 1995; 75: 2474-83.
DiGiuseppe J, Louie D, Williams J, Miller D, Griffin C, Mann R, et al. Blastic natural killer cell leukemia/ lymphoma: a clinicopathologic study. Am J Surg Pathol 1997; 21: 1223-30.
Kameoka J, Ichinohasama R, Tanaka M, Miura I, Tomiya Y, Takahashi S, et al. A cutaneous agranular CD2- CD4+ CD56+ «lymphoma»: report of two cases and review of the literature. Am J Clin Pathol 1998; 110: 478-88.
Petrella T, Dalac S, Maynadié M, Mugneret F, Thomine E, Courville P, et al. CD4+ CD56+ cutaneous neoplasms: a distinct hematological entity? Am J Surg Pathol 1999; 23: 137-46.
Chan J, Jaffe E, Ralfkiaer E. Blastic NK-cell lymphoma. En: Jaffe E, Harris N, Stein H, Vardiman J, editores. World Health Organization Classification of Tumours: Pathology & Genetics. Tumours of Haematopoietic and Lymphoid Tissues. Lyon (Francia): IARC Press; 2001. p. 214-5.
Kato N, Yasukawa K, Kimura K, Sugawara H, Aoyagi S, Mishina T, et al. CD2-CD4+CD56+ hematodermic/hematolymphoid malignancy. J Am Acad Dermatol 2001; 44: 231-8.
Chaperot L, Bendriss N, Manches O, Gressin R, Maynadie M, Trimoreau F, et al. Identification of a leukemic counterpart of the plasmacytoid dendritic cells. Blood 2001; 97: 3210-7.
Feuillard J, Jacob M, Valensi F, Maynadié M, Gressin R, Chaperot L, et al. Clinical and biological features of CD4+CD56+ malignancies. Blood 2002; 99: 1556-63.
Jacob M, Chaperot L, Mossuz P, Feuillard J, Valensi F, Leroux D, et al. CD4+ CD56+ lineage negative malignancies: a new entity developed from malignant early plasmacytoid dendritic cells. Haematologica 2003; 88: 941-55.
Willemze R, Jaffe E, Burg G, Cerroni L, Berti E, Swerdlow S, et al. WHO-EORTC classification for cutaneous lymphomas. Blood 2005; 105: 3768-85.
Bekkenk M, Jansen P, Meijer C, Willemze R. CD56+ hematological neoplasms presenting in the skin: a retrospective analysis of 23 new cases and 130 cases from the literature. Ann Oncol 2004; 15: 1097-108.
Karube K, Ohshima K, Tsuchiya T, Yamaguchi T, Suefuji H, Suzumiya J, et al. Non-B, non-T neoplasms with lymphoblast morphology: further clarification and classification. Am J Surg Pathol 2003; 27: 1366-74.
Petrella T, Wechsler J, Courville P, de Muret A, Bosq J, Dechelotte P, et al. Hematodermic CD4/CD56 neoplasm. Ann Pathol 2004; 24: 241-55.
Paulli M, Berti E. Cutaneous T-cell lymphomas (including rare subtypes). Current concepts. II. Haematologica 2004; 89: 1372-88.
Massone C, Chott A, Metze D, Kerl K, Citarella L, Vale E, et al. Subcutaneous, blastic natural killer (NK), NK/T-cell, and other cytotoxic lymphomas of the skin. Am J Surg Pathol 2004; 28: 719-35.
Nava V, Jaffe E. The pathology of NK-cell lymphomas and leukemias. Adv Anat Pathol 2005; 12: 27-34.
Reichard K, Burks E, Foucar M, Wilson C, Viswanatha D, Hozier J, et al. CD4(+) CD56(+) lineage-negative malignancies are rare tumors of plasmacytoid dendritic cells. Am J Surg Pathol 2005; 29: 1274-83.
Khoury J, Medeiros L, Manning J, Sulak L, Bueso-Ramos C, Jones D. CD56(+) TdT (+) blastic natural killer cell tumor of the skin: a primitive systemic malignancy related to myelomonocytic leukemia. Cancer 2002; 94: 2401-8.
Ko Y, Kim S, Ree H. Blastic NK-cell lymphoma expressing terminal deoxynucleotidiyl transferase with Homer-Wright type pseudorosettes formation. Histopathology 1998; 33: 547-53.
Kim Y, Kang M, Kim C, Sung R, Ko Y. CD4+CD56+ lineage negative hematopoietic neoplasm: so called blastic NK cell lymphoma. J Korean Med Sci 2005; 20: 319-24.
Wu H, Ren R, Roepke J. Fine-needle aspiration cytology of blastic natural killer-cell lymphoma (CD4+ CD56+ hematodermic neoplasm). Diagn Cytopathol 2004; 30: 268-70.
Mukai H, Kojima H, Suzukawa K, Hori M, Komeno T, Hasegawa Y, et al. High-dose chemotherapy with peripheral blood stem cell rescue in blastoid natural killer cell lymphoma. Leuk Lymphoma 1999; 32: 583-8.
Kojima H, Mukai H, Shinagawa A, Yoshida C, Kamoshita M, Komeno T, et al. Clinicopathological analyses of 5 Japanese patients with CD56+ primary cutaneous lymphomas. Int J Hematol 2000; 72: 477-83.
Mhawech P, Medeiros L, Bueso-Ramos C, Coffey D, Gei A, Shahab I. Natural killer-cell lymphoma involving the gynecologic tract. Arch Pathol Lab Med 2000; 124: 1510-3.
Nagatani T, Okazawa H, Kambara T, Satoh K, Tokura H, Miyazawa M, et al. Cutaneous monomorphous CD4- and CD56-positive large cell lymphoma. Dermatol 2000; 200: 202-8.
Urosevic M, Conrad C, Kamarashev J, Asagoe K, Cozzio A, Burg G, et al. CD4+CD56+ hematodermic neoplasms bear a plasmacytoid dendritic cell phenotype. Hum Pathol 2005; 36: 1020-4.
Herling M, Teitell M, Shen R, Medeiros J, Jones D. TCL1 expression in plasmacytoid dendritic cells (DC2s) and the related CD4+ CD56+ blastic tumors of skin. Blood 2003; 101: 5007-9.
Petrella T, Meijer C, Dalac S, Willemze R, Maynadie M, Machet L, et al. TCL-1 and CLA expression in agranular CD4/CD56 hematodermic neoplasms (blastic NK-cell lymphomas) and leukemia cutis. Am J Clin Pathol 2004; 122: 307-13.
Kanazawa N, Tashiro K, Mivachi Y. Signaling and immune regulatory role of the dendritic cell immunoreceptor (DCIR) family lectins: DCIR, DCAR, dectin-2 and BDCA-2. Immunobiol 2004; 209: 179-90.
Said J, Hoyer K, French S, Rosenfelt L, Garcia-Lloret M, Koh P, et al. TCL1 oncogene expression in B cell subsets from lymphoid hyperplasia and distinct classes of B cell lymphoma. Lab Invest 2001; 81: 555-64.
Roos J, Hennig I, Schwaller J, Zbaren J, Dummer R, Burg G, et al. Expression of TCL1 in hematologic disorders. Pathobiology 2001; 69: 59-66.
Pekarsky Y, Hallas C, Croce C. Molecular basis of mature T-cell leukemia. JAMA 2001; 286: 2308-14.
Chun H, Castellvi-Bel S, Wang Z, Nagourney R, Plaeger S, Becker-Catania S, et al. TCL-1, MTCP-1 and TML-1 gene expression profile in non-leukemic clonal proliferations associated with ataxia-telangiectasia. Int J Cancer 2002; 97: 726-31.
Grouard G, Rissoan M, Filgueira L, Durand I, Banchereau J, Liu Y. The enigmatic plasmacytoid T cells develop into dendritic cells with interleukin (IL)-3 and CD-40-ligand. J Exp Med 1997; 185: 1101-11.
Leroux D, Mugneret F, Callanan M, Radford-Weiss I, Dastugue N, Feuillard J, et al. CD4+, CD56+ DC2 acute leukemia is characterized by recurrent clonal chromosomal changes affecting 6 major targets: a study of 21 cases by the Groupe Français de Cytogénétique Hématologique. Blood 2002; 99: 4154-9.
Lennert K, Remmele W. Karyometrische untersuchungen an lymphknotenzellen des menschen. I. Mitteilung: germinoblasten, lymphoblasten und lymphozyten. Acta Haematol 1958; 19: 99-113.
Lennert K, Kaiserling E, Müller-Hermelink H. T-associated plasma cells. Lancet 1975; 1: 1031-2.
Lennert K, Stein H, Müller-Hermelink J, Vollenweider R. T cells with plasmacytoid features. En: Bernard A, Boumsell L, Dausset J, Milstein C, Schlossman S, editores. Leukocyte Typing. Human Leukocyte Differentiation Antigens Detected by Monoclonal Antibodies. Berlin (Alemania): Springer-Verlag. 1984.
Facchetti F, de Wolf-Peeters C, Mason D, Pulford K, van der Oord J, Desmet V. Plasmactoid T cells. Immunohistochemical evidence for their monocyte/macrophage origin. Am J Pathol 1988; 133: 15-21.
O´Doherty U, Peng M, Gezelter S, Swiggard W, Betjes M, Bhardwaj N, et al. Human blood contains two subsets of dendritic cells, one immunologically mature and the other immature. Immunology 1994; 82: 487-93.
Hart D. Dendritic cells: unique leukocyte populations which control the primary immune response. Blood 1997; 90: 3245-87.
Vandenabeele S, Wu L. Dendritic cell origins: puzzles and paradoxes. Immunol Cell Biol 1999; 77: 411-9.
Brière F, Bendriss-Vermare N, Delale T, Burg S, Corbet C, Rissoan M, et al. Origin and filiation of human plasmacytoid dendritic cells. Hum Immunol 2002; 63: 1081-93.
McKenna K, Beignon A, Bhardwaj N. Plasmacytoid dendritic cells: linking innate and adaptive immunity. J Virol 2005; 79: 17-27.
Banchereau J, Steinman R. Dendritic cells and the control of immunity. Nature 1998; 392: 245-52.
Schotte R, Rissoan M, Bendriss-Vermare N, Bridon J, Duhen T, Weijer K, et al. The transcription factor Spi-B is expressed in plasmacytoid DC precursors and inhibits T-, B-, and NK-cell development. Blood 2003; 101: 1015-23.
Yang G, Lian Z, Kikuchi K, Moritoki Y, Ansari A, Liu Y, et al. Plasmacytoid dendritic cells of different origins have distinct characteristics and function: studies of lymphoid progenitors versus myeloid progenitors. J Immunol 2005; 175: 7281-7.
Olweus J, BitMansour A, Warnke R, Thompson P, Carballido J, Picker L, et al. Dendritic cell ontogeny: a human dendritic cell lineage of myeloid origin. Proc Natl Acad Sci USA 1997; 94: 12551-6.
Müller-Hermelink H, Stein H, Steinmann G, Lennert K. Malignant lymphoma of plasmacytoid T-cells. Morphologic and immunologic studies characterizing a special type of T-cell. Am J Surg Pathol 1983; 7: 849-62.
Papadimitriou C, Stephanaki-Nikou S, Malamou-mitsi V. Comparative immunostaining of T-cell associated plasma cells and other lymph-node cells in paraffin section. Virchows Arch (Cell Pathol) 1983; 43: 31-6.
Steinman R. The dendritic cell system and its role in immunogenicity. Annu Rev Immunol 1991; 9: 271-96.
Fonteneau J, Gilliet M, Larsson M, Dasilva I, Münz C, Liu YJ, et al. Activation of influenza virus–specific CD4+ and CD8+ T cells: a new role for plasmacytoid dendritic cells in adaptive immunity. Blood 2003; 101: 3520-6.
Svensson H, Cederblad B, Lindahl M, Alm G. Stimulation of natural interferon-alpha/beta-producing cells by Staphylococcus aureus. J Interferon Cytokine Res 1996; 16: 7-16.
Pichyangkul S, Yongvanitchit K, Kum-arb U, Hemmi H, Akira S, Krieg A, et al. Malaria blood stage parasites activate human plasmacytoid dendritic cells and murine dendritic cells through a Toll-like receptor 9-dependent pathway. J Immunol 2004; 172: 4926-33.
Krug A, Rothenfusser S, Hornung V, Jahrsdorfer B, Blackwell S, Ballas Z, et al. Identification of CpG oligonucleotide sequences with high induction of IFN-alpha/beta in plasmacytoid dendritic cells. Eur J Immunol 2001; 31: 2154-63.
Krug A, Luker G, Barchet W, Leib D, Akira S, Colonna M. Herpes simplex virus type 1 activates murine natural interferon-producing cells through toll-like receptor 9. Blood 2004; 103: 1433-7.
Hemmi H, Kaisho T, Takeuchi O, Sato S, Sanjo H, Hoshino K, et al. Small anti-viral compounds activate immune cells via the TLR7 MyD88-dependent signaling pathway. Nat Immunol 2002; 3: 196-200.
Hemmi H, Kaisho T, Takeda K, Akira S. The roles of Toll-like receptor 9, MyD88, and DNA-dependent protein kinase catalytic subunit in the effects of two distinct CpG DNAs on dendritic cell subsets. J Immunol 2003; 170: 3059-64.
Bendriss-Vermare N, Chaperot L, Peoc´h M, Vanbervliet B, Jacob M, Brière F, et al. In situ leukemic plasmacytoid dendritic cells pattern of chemokine receptors expression and in vitro migratory response. Leukemia 2004; 18: 1491-8.
Vermi W, Riboldi E, Wittamer V, Gentili F, Luini W, Marelli S, et al. Role of ChemR23 in directing the migration of myeloid and plasmacytoid dendritic cells to lymphoid organs and inflamed skin. J Exp Med 2005; 201: 509-15.
Zou W, Machelon V, Coulomb-L’Hermin A, Borvak J, Nome F, Isaeva T, et al. Stromal-derived factor-1 in human tumors recruits and alters the function of plasmacytoid precursor dendritic cells. Nat Med 2001; 7: 1339-46.
Abb J, Abb H, Deinhardt F. Phenotype of human alpha-interferon producing leukocytes identified by monoclonal antibodies. Clin Exp Immunol 1983; 52: 179-84.
Chehimi J, Starr S, Kawashima H, Miller D, Trinchieri G, Perussia B, et al. Dendritic cells and IFN-alpha-producing cells are two functionally distinct non-B, non-monocytic HLA-DR+ cell subsets in human peripheral blood. Immunology 1989; 68: 488-90.
Fitzgerald-Bocarsly P. Human natural interferon-alpha producing cells. Pharmacol Ther 1993; 60: 39-62.
Liu Y. Dendritic cell subsets and lineages, and their functions in innate and adaptive immunity. Cell 2001; 106: 259-62.
Boonstra A, Asselin-Paturel C, Gilliet M, Crain C, Trinchieri G, Liu Y, et al. Flexibility of mouse classical and plasmacytoid-derived dendritic cells in directing T helper type 1 and 2 cell development: dependency on antigen dose and differential Toll-like receptor ligation. J Exp Med 2003; 197: 101-9.
Kaiserling E, Stein H, Müller-Hermelink H. Interdigitating reticulum cells in the human thymus. Cell Tissue Res 1974; 155: 47-55.
Kaiserling E, Lennert K. Interdigitating reticulum cell in the human lymph node. A specific cell of the thymus dependent region. Virchows Arch B Cell Pathol 1974; 16: 51-64.
Gilliet M, Liu Y. Generation of human CD8 T regulatory cells by CD40 ligand-activated plasmacytoid dendritic cells. J Exp Med 2002; 195: 695-704.
Furgier-Vivier I, Rezzoug F, Huang Y, Graul-Layman A, Schanie C, Xu H, et al. Plasmacytoid precursor dendritic cells facilitate allogeneic hematopoietic stem cell engraftment. J Exp Med 2005; 201: 373-83.
Walker E, Rosenthal H, Jones T, Peel J, Lonial S, Langston A, et al. Larger number of CD4 (bright) dendritic cells in donor bone marrow are associated with increased relapse after allogeneic bone marrow transplantation. Blood 2001; 97: 2948-56.
Eckert F, Schmid U. Identification of plasmacytoid T cells in lymphoid hyperplasia of the skin. Arch Dermatol 1989; 125: 1518-24.
Facchetti F, Boden G, de Wolf-Peeters C, Vandaele R, Degreef H, Desmet V. Plasmacytoid monocytes in Jessner´s lymphocytic infiltration of the skin. Am J Dermatopathol 1990; 12: 363-9.
Salio M, Cella M, Vermi W, Facchetti F, Palmowski M, Smith C, et al. Plasmacytoid dendritic cells prime IFN-gamma-secreting melanoma-specific CD8 lymphocytes and are found in primary melanoma lesions. Eur J Immunol 2003; 33: 1052-62.
Vermi W, Bonecchi R, Facchetti F, Bianchi D, Sozzani S, Festa S, et al. Recruitment of immature plasmacytoid dendritic cells (plasmacytoid monocytes) and myeloid dendritic cells in primary cutaneous melanomas. J Pathol 2003; 200: 255-68.
Hartmann E, Wollenberg B, Rothenfusser S, Wagner M, Wellisch D, Mack B, et al. Identification and functional analysis of tumor-infiltrating plasmacytoid dendritic cells in head and neck cancer. Cancer Res 2003; 93: 6478-87.
Baddoura F, Hanson C, Chan W. Plasmacytoid monocyte proliferation associated with myeloproliferative disorders. Cancer 1992; 69: 1457-67.
Lore K, Smed-Sorensen A, Vasudevan J, Mascola J, Koup R. Myeloid and plasmacytoid dendritic cells transfer HIV-1 preferentially to antigen-specific CD4+ T cells. J Exp Med 2005; 201: 2023-33.
Chehimi J, Campbell D, Azzoni L, Bacheller D, Papasavvas E, Jerandi G, et al. Persistent decreases in blood plasmacytoid dendritic cell number and function despite effective highly active antiretroviral therapy and increased blood myeloid dendritic cells in HIV-infected individuals. J Immunol 2002; 168: 4796-801.
Pakanowski J, Kahi S, Baillet M, Lebon P, Deveau C, Goujard C, et al. Reduced blood CD123+ (lymphoid) and CD11c+ (myeloid) dendritic cell numbers in primary HIV-1 infection. Blood 2001; 98: 3016-21.
Barron M, Blyveis N, Palmer B, MaWhinney S, Wilson C. Influence of plasma viremia on defects in number and immunophenotype of blood dendritic cell subsets in human immunodeficiency virus 1-infected individuals. J Infect Dis 2003; 187: 26-37.
Donaghy H, Pozniak A, Gazzard B, Qazi N, Gilmour J, Gotch F, et al. Loss of blood CD11c+ myeloid and CD11c- plasmacytoid dendritic cells in patients with HIV-1 infection correlates with HIV-1 RNA virus load. Blood 2001; 98: 2574-6.
Donaghy H, Gazzard B, Gotch F, Patterson S. Dysfunction and infection of freshly isolated blood myeloid and plamacytoid dendritic cells in patients infected with HIV-1. Blood 2003; 101: 4505-11.
Siegal F, Fitzgerald-Bocarsly P, Holland B, Shodell M. Inferferon-alpha generation and immune reconstitution during antiretroviral therapy for human immunodeficiency virus infection. AIDS 2001; 15: 1603-12.
Jordan C, Upchurch D, Szilvassy S, Guzman M, Howard D, Pettigrew A, et al. The interleukin-3 receptor a chain is a unique marker for human acute myelogenous leukemia stem cells. Leukemia 2000; 14: 1777-84.
Muñoz L, Nomdedéu J, López O, Carnicer M, Bellido M, Aventín A, et al. Interleukin-3 receptor a chain (CD123) is widely expressed in hematologic malignancies. Haematologica 2001; 86: 1261-9.
Del Giudice I, Matutes E, Morilla R, Morilla A, Owusu-Ankomah K, Rafiq F, et al. The diagnosic value of CD123 in B-cell disorders with hairy or villous lymphocytes. Haematologica 2004; 89: 303-8.
Ransohoff R. Cellular responses to interferons and other cytokines: the JAK/STAT paradigm. N Engl J Med 1998; 338: 616-8.
Petrella T, Comeau M, Maynadié M, Couillault G, De Muret A, Maliszewski C, et al. ‘Agranular CD4+ CD56+ hematodermic neoplasm’ (blastic NK-cell lymphoma) originates from a population of CD56+ precursor cells related to plasmacytoid monocytes. Am J Surg Pathol 2002; 26: 852-62.