
Vol. 39, n.º 4, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 4, 2006 |
ORIGINALES
Francisco O’Valle, María del Carmen Benítez, David Martín-Oliva1, Raimundo MG. del Moral, Mercedes Gómez-Morales, Cristina Godoy, Fernando García del Moral, Mariano Aguilar, Francisco Oliver2, Raimundo G. del Moral
Dpto. de Anatomía Patológica e Instituto de
Biopatología y Medicina Regenerativa (IBIMER).
1 Dpto. de Biología Celular, Universidad de Granada. Instituto de
Parasitología y Biomedicina, CSIC. Granada.
2 Instituto de Parasitología y Biomedicina, CSIC.
fovalle@ugr.es
RESUMEN
Poli (ADP-Ribosa) polimerasa (PARP-1) cataliza la ADP ribosilación de proteínas usando NAD(+) como sustrato. La activación de PARP-1 conduce a la depleción intracelular de NAD(+). El daño por isquemia-reperfusión (IR) induce una activación excesiva de PARP-1 y la muerte celular por consumo masivo de ATP. Nuestra hipótesis de trabajo es que la excesiva expresión tubular de PARP-1 en riñones humanos trasplantados es una de las causas directas de la inducción de necrosis tubular aguda (NTA) y contribuye al retraso de la función renal del injerto. Material y Métodos: Estudiamos 193 biopsias de trasplante renal (95 preimplante –biopsia de donante– y 98 postrasplante) incluidas en parafina con diferentes grados de NTA y 65 biopsias renales de donante sin NTA. La NTA se estratificó en cuatro grados: ausente (0); leve (1) [<10% de los túbulos con células necróticas]; moderada (2) [10 al 49%]; o severa (3) [>50%]. La expresión nuclear de PARP-1 fue evaluada mediante inmunohistoquímica con el kit de polimeros conjugado con peroxidasa MasVision y el anticuerpo anti-PARP-1 (clón PARP01) y valorada semicuantitativamente de 0 a 3. Resultados: La expresión nuclear de PARP-1 antecedió a los cambios morfológicos sugerentes de NTA. Principalmente la inmunotinción se localizó en los núcleos de células tubulares, cuando fue intensa la lesión también apareció en glomérulos (epitelio de la cápsula de Bowman y células endoteliales de capilares glomerulares). La inmunotición fue observable hasta fases finales de la necrosis tubular. La totalidad de las 95 biopsias renales pre-trasplante con NTA grado 1 (86%) o grado 2 (14%) mostraron expresión nuclear de PARP-1 en túbulos. Las 98 biopsias postrasplante con NTA mostraron expresión más intensa de PARP-1 [grado 2 (45%), grado 3 (25%)]. El grado de NTA se correlacionó significantivamente con la expresión de PARP-1(r=0,565, p=0,0001, test de Pearson), con una expresión media 2,74±0,45 en los casos de NTA severa frente a 1,94±0,74 en los casos de NTA leve y 0,29±0,45 en los casos sin NTA (p=0,0001, test ANOVA de una vía). En conclusión, PARP-1 está vinculado a la inducción de NTA y desempeña un papel importante en el comportamiento de la función precoz del injerto renal ya que está correlacionada significativamente con el tiempo en recuperar la diuresis eficaz (r=0,578, p=0,0001, test de Pearson) y con los niveles séricos de creatinina en el momento de la biopsia (r=0,649), y a los 3 meses (r=0,363, p=0,0001, test de Pearson) pero no a los 6 y 12 meses postrasplante.
Palabras clave: PARP-1, riñón, trasplante, NTA.
SUMMARY
Poly (ADP-Ribose) Polymerase (PARP-1) catalyzes ADP-ribosylation of proteins using NAD(+) as substrate. Its overactivation leads to massive NAD+ consumption and ATP depletion. The ischemia/reperfusion injury (IR) induces PARP-1 overactivation and leads to cellular necrosis by massive ATP consumption. Our working hypothesis was that massive PARP-1 tubular expression in allograft human kidneys are a direct cause of acute tubular necrosis (ATN) and contribute to delay in early recovery of renal function (RRF) of the transplanted organ. Material and Methods: A total of 193 paraffin embedded renal allograft biopsies (95 pre-implant –donor biopsies– and 98 post-implant) with several ATN degrees, and 65 control renal biopsies from donors without ATN were studied. ATN degree was classified as: Absence (0); mild (1) [<10% of tubules with necrotic cells]; moderate (2) [10 to 49%]; or severe (3) [>50%]. Nuclear expression of PARP-1 in tubular cells was evaluated by immunohistochemistry using polymer-conjugate MasVision kit and the monoclonal antibody anti-PARP-1 (clone PAR01). It was semiquantitatively determined, and scored from 0 to 3. Results: The nuclear PARP-1 preceded the morphological features of ATN. Immunostaining was located mainly in tubular cells nuclei, in cases of intense injury also was observed in glomeruli (capillary endothelial cells and epithelial cells of Bowman’s capsule). Immunostaining was observed until advanced ATN condition. All 95 pre-transplant renal biopsies with ATN degree 1 (86%) or degree 2 (14%) showed tubular nuclei PARP-1 expression. The 98 post-transplant biopsies with ATN showed more intense expression of PARP-1 [degree 2 (45%), degree 3 (25%)]. Statistically significant relationship between ATN degree and PARP-1 expression was found (r=0.565, p=0.0001, Pearson test), with a mean expression of 2.74±0.45 in sever ATN cases versus 1.94±0.74 in mild ATN cases, and 0.29±0.45 in non-ATN cases (p=0.0001, one way ANOVA test). In conclusion, PARP-1 are linked to induction of ATN, and plays an important role in early graft renal function. This fact is indicated by the stati! stically significant relation with delay in total RRF (r=0.578, p=0.0001, Pearson test), creatinine serum levels at biopsy time (r=0.649) and at 3 months (r=0.363, p=0.0001, Pearson test), but not at 6 or 12 months post-transplant.
Key words: PARP-1, kidney, transplant, ATN.
INTRODUCCIÓN
PARP-1 (E.C. 2.4.2.30) es una proteína nuclear de 116 kDa de masa molecular con dos motivos dedo de zinc, que se fija al ADN y detecta específicamente mellas o rupturas del ADN producidas por diferentes agentes genotóxicos (1). PARP-1 cataliza la ADP-ribosilación de proteínas usando NAD(+) como sustrato (2). La activación de PARP es una consecuencia del daño isquémico y conduce a la depleción intracelular NAD(+) (3), el cual sólo puede ser repuesto consumiendo ATP. La lesión por isquemia/reperfusión (I/R) produce como resulta un sustancial daño del ADN y las células necesitan consumir grandes cantidades de ATP para soportar la poli(ADP-ribosilación) reparativa. Por esta razón, mientras que una actividad moderada de PARP-1 protege la integridad del genoma celular, la excesiva activación de PARP-1 conduce a la muerte celular por depleción de ATP (4-6). Nuestro grupo previamente ha demostrado que la expresión tubular de PARP-1 en riñones de donantes subóptimos está relacionado de manera estadísticamente significativa con algunos parámetros indicadores de la reserva funcional (creatinina sérica y tiempo requerido para alcanzar la diuresis eficaz) (7). PARP-1 ha sido recientemente involucrado en la patogénesis de la lesión por I/R en diferentes modelos animales (8) y se ha demostrado experimentalmente que la inhibición farmacológica de PARP-1 en riñones y en otros órganos de rata (9,10) o la supresión del gen parp-1 en ratones knockout (11) reduce el daño subsiguiente a la reperfusión.
La insuficiencia renal aguda secundaria a isquemia y el retraso de la función renal del injerto están vinculados a la agresión por radicales libres, con generación de aniones superóxido, peróxido de hidrógeno y óxido nítrico durante la reperfusión tisular. El óxido nítrico se comporta como un tóxico dando lugar al anión peroxinitrito, que causa rápida oxidación y modificación covalente por nitración e hidroxilación de las proteínas, produciendo rotura de la doble cadena de ADN, sobreactivación de la PARP-1, y depleción masiva del NAD(+) intracelular, que se repone por consumo de ATP. Cuando el fenómeno se produce en células sometidas a hipoxia el excesivo consumo de ATP requerido conduce a las células, desde una lesión subletal, hasta el punto de no retorno, muerte celular por necrosis (12-17).
Las lesiones observadas en el fracaso renal agudo asociado a I/R se englobaban bajo el término de necrosis tubular aguda (NTA). Actualmente, se reconoce que la muerte y ulterior eliminación de las células epiteliales tubulares ocurren por dos vías, apoptosis y necrosis. La proporción de células afectadas por cada tipo de muerte celular y la extensión de la lesión estarían determinadas por la duración del período de anoxia (17). A su vez se encontraría modulado por la mayor o menor sensibilidad de algunas porciones de la nefrona frente a la isquemia. Como está demostrado el túbulo contorneado proximal y la porción ascendente del asa de Henle son las más sensibles al daño por I/R, por lo que se ha propuesto que, a igualdad de lesión a este nivel, serían más frecuentes observar los fenómenos morfológicos de necrosis y en el resto de la nefrona los fenómenos de apoptosis (17).
Nuestra hipótesis es que la excesiva expresión tubular de PARP-1 en riñones trasplantados es una de las causas directas de la inducción de NTA y contribuye al retraso de la función renal del injerto.
MATERIAL Y MÉTODOS
Estudiamos 193 biopsias de trasplante renal incluidas en parafina (95 preimplante –biopsia de donante– y 98 postrasplante) que presentaban diferentes grados de NTA y 65 biopsias renales de donante sin NTA. Las 160 biopsias preimplante fueron fijadas en Glyofix (Pacisa-Giralt, Barcelona, España) y embebidas en parafina por un procedimiento de inclusión acelerada en horno de microondas modelo Energy Beam Sciences H2800 (Vitro SA, Sevilla, España) para determinar las lesiones a tiempo 0-h (pretrasplante). 98 cilindros renales obtenidos en la primera semana postrasplante por presentar los pacientes deterioro de la función renal con oligoanuria e incremento de la creatinina sérica, fueron fijados en formalina tamponada al 10% y embebidos en parafina según procedimiento estándar en un procesador Shandon Pathcentre con cámara de vacío (Shandon, Barcelona, España) para identificar la presencia de NTA, la cual fue estratificada en los siguientes grados: Leve (1) [<10% de los túbulos con células necróticas]; moderada (2) [10 a 49%]; o severa (3) [>50%]. Usamos como grupo control 65 cuñas renales procedentes de donante sin evidencia morfológica de NTA. El estudio fue aprobado por el comité ético del hospital y realizado de acuerdo con la declaración de Helsinki. Todas las biopsias fueron obtenidas tras consentimiento informado de los pacientes o familiares y fueron valoradas a doble ciego de forma independiente por dos patólogos.
La expresión nuclear de PARP-1 fue caracterizada incubando las secciones durante 60 minutos a temperatura ambiente con el anticuerpo monoclonal PARP-1 (clón PAR01) (LabVision Fremont, CA, USA). El estudio inmunohistoquímico fue realizado en un inmunoteñidor automático (LabVision) usando el kit MasVision basado en técnica de polímeros conjugado con peroxidasa (Master Diagnóstica, Granada, España) y revelado con diaminobencidina (DAB) durante 10 minutos, añadiendo posteriormente potenciador de la DAB durante 2 minutos (Master Diagnóstica). La positividad de la inmunotinción fue calculada de manera semicuantitativa en una escala de 0 a 3 (0, ausencia; 1 [1-9% de los núcleos tubulares positivos]; 2 [10-49%]; 3 [>50%]).
De las historias clínicas fueron seleccionados algunos parámetros de función renal (creatinina sérica expresada en mg/dL, aclaramiento de creatinina obtenida de la relación [mL/min./1,73 m2]), edad del donante y del receptor, sexo, tiempo de isquemia fría, tiempo de reanastomosis, tiempo en recuperar la diuresis eficaz (definido como el tiempo en obtener un aclaramiento de creatinina calculada según Cockcroft-Gault suficiente para no necesitar tratamiento con hemodiálisis tras el trasplante).
RESULTADOS
En 193 biopsias renales fue detectada la presencia histopatológica de NTA con intensidad leve en el 56,5%, moderada en el 31,1% y severa en el 12,4% de las biopsias. Los controles fueron seleccionados de las biopsias pretrasplante sin evidencia morfológica de NTA (tabla 1).
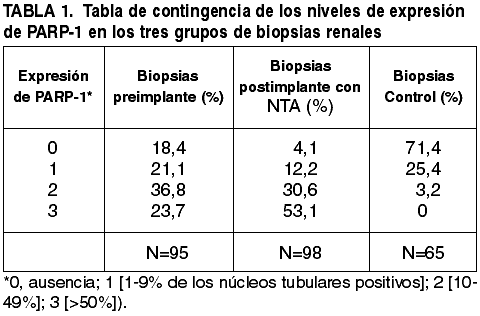
La expresión nuclear de PARP-1 precedió a los cambios histopatológicos sugerentes de NTA (figs. 1A-D). Principalmente la inmunotinción se localizó en los núcleos de células tubulares y cuando fue muy intensa la lesión también apareció en glomérulos (epitelio de la cápsula de Bowman y células endoteliales de capilares glomerulares) (fig. 1E). La inmunotición fue observable hasta fases finales de la necrosis tubular con positividad en núcleos picnóticos y restos nucleares en áreas de infarto renal (figs. 1G y 1H). El 81,6% de las 95 biopsias renales pretrasplante con NTA grado 1 o grado 2 mostraron expresión nuclear de PARP-1 en túbulos. Las 98 biopsias postrasplante con NTA mostraron expresión más intensa de PARP-1 [PARP-1 grado 2 (45%), PARP-1 grado 3 (25%)] y sólo en el 4,1% de las biopsias no se detectó expresión de PARP-1 (tabla 1). El grado de NTA se correlacionó significativamente con la expresión de PARP-1 (r=0,565, p=0,0001, test de Pearson) (fig. 2), con una expresión media 2,74±0,45 en los casos de NTA severa frente a 1,94±0,74 en los casos de NTA leve y 0,29±0,45 en los casos sin NTA (p=0,0001, test ANOVA de una vía). En la figura 3 se representa el efecto que sobre la expresión tubular de PARP-1 tiene una prologada duración del tiempo de isquemia fría (>20 horas) (fig. 3A); como el retraso de la recuperación de la diuresis (>10 días) se ve acompañado de una mayor expresión tubular de PARP-1 (fig. 3B) y por último como en aquellos trasplantes que a lo largo del seguimiento no alcanzaron niveles de creatinina sérica <1,7 mg/dL fue manifiesta la mayor expresión inmunohistoquímica de PARP-1 en el parénquima renal (fig. 3C), todo ello de manera estadísticamente significativa (p=0,0001, test t de Student).
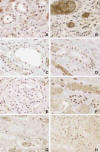
Fig. 1:
Expresión nuclear de PARP-1. A, B y C: la
expresión antecede a los cambios morfológicos de NTA. D: Expresión nuclear de
PARP-1 en túbulos conservados y en células picnóticas de un túbulo con NTA. E:
Expresión nuclear en glomérulo. F: Expresión nuclear de PARP-1 mantenida hasta
fases finales de la necrosis tubular y en áreas de infarto renal (G y H)
(Polímero-peroxidasa x200).
![]()
Fig. 2:
Ilustra el hallazgo de que a mayor grado de
necrosis mayor expresión de PARP-1. A) Necrosis tubular aguda leve (H&E x200).
Inserto: expresión nuclear de PARP-1 grado 1 (Polimero-peroxidasa x200). B)
Necrosis tubular aguda moderada (H&E x200) Inserto: expresión nuclear de PARP-1
grado 2 (Polimero-peroxidasa x200).
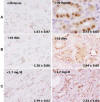
Fig. 3:
Expresión de PARP-1 y su relación con A) el
tiempo de isquemia fría sufrida (<20 horas>); B) el tiempo en recuperar la
función primaria (<10 dias>) y C) si en la evolución alcanza cifras inferiores a
1.7 mg/dL de crearinina sérica (Polímero-peroxidasa x200).
En resumen, PARP-1 está vinculado junto con otros factores a la inducción de NTA y desempeña un papel importante en el comportamiento de la función precoz del injerto renal, ya que está correlacionada significativamente con el tiempo en recuperar la diuresis eficaz (r=0,578, p=0,0001, test de Pearson) y con los niveles séricos de creatinina en el momento de la biopsia (r=0,649), y a los 3 meses (r=0,363, p=0,0001, test de Pearson), aunque no a los 6 y 12 meses postrasplante.
DISCUSIÓN
En el trasplante renal, las lesiones de I/R, sobretodo en órganos de donantes subóptimos, determinan en gran medida el retraso en la recuperación de la función del injerto, así como la posible evolución precoz del mismo hacia la nefropatía crónica (2,12). La NTA es la forma de daño renal descrita con más frecuencia en los fenómenos de isquemia fría a que se someten los riñones antes de ser trasplantados, principalmente los que provienen de donante cadáver, ya que el grado de lesión celular está en relación directa al tiempo de isquemia (13-15).
Los modelos propuestos de mecanismos de lesión renal incluyen la acumulación de metabolitos de desecho en los tejidos isquémicos carentes de oxígeno y nutrientes. A nivel celular los principales cambios bioquímicos son la inhibición del metabolismo oxidativo, con depleción de ATP e inhibición de las bombas de membrana transportadoras de iones; el incremento de la glicólisis anaerobia con descenso del pH intracelular e incremento de la inestabilidad lisosomal con activación de enzimas proteolíticas; el incremetno de la óxido nítrico sintetasa inducible y el descenso de la expresión de genes citoprotectores (17). El ATP es rápidamente degradado a hipoxantina, la cual en ausencia de oxígeno, no puede ser metabolizada; pero a través de la xantina oxidasa genera radicales libres.
La activación de PARP-1 es parte de la cascada de eventos moleculares que ocurren después del daño I/R en el riñón y su expresión puede estar aumentada en los túbulos renales desde el comienzo del proceso. En condiciones normales la activación de PARP-1 tiene como finalidad la reparación del DNA; pero situaciones de isquemia como ocurre en los riñones que sufren NTA postrasplante, producen una expresión excesiva de PARP-1 (15,16). Esta sobreactivación de la enzima PARP-1 contribuiría a la disfunción del injerto y a la NTA que se observa después de la reperfusión del tejido renal que sigue al periodo de isquemia fría (15,17). En este trabajo comprobamos, que existe una relación sustentada estadísticamente entre el daño celular por NTA y la mayor expresión nuclear de PARP-1 en los túbulos renales de biopsias de pacientes que han sufrido un tiempo variable de isquemia fría y posterior reperfusión. Un hecho relevante es que tiempos de isquemia fría superiores a 20 horas se acompañan de mayor incidencia de NTA y mayor expresión de PARP-1, este umbral parece crítico tanto para riñones procedente de donantes subóptimos como de donantes más jóvenes y sería deseable no superarlo para conseguir una recuperación precoz de la función del injerto renal. La correlación establecida entre el tiempo de isquemia fría y PARP-1 hace de éste último un factor patogénico que explicaría por qué los mayores tiempos de isquemia fría se acompañan de retraso en la diuresis eficaz y peor función renal del injerto, un hecho que aunque ya conocido permanecía incompletamente estudiado (14,15).
La detección de expresión de PARP-1 de intensidad débil en el 25% y moderada en el 3,2% de las biopsias control sin NTA detectable morfológicamente podría explicarse por el hecho de que la expresión inmunohistoquímica antecede a los eventos morfológicos, aunque también hemos encontrado casos de biopsias preimplante con NTA (18,4%) en los que no detectamos expresión de PARP-1, posiblemente debido a problemas intrínsecos del tejido, de la técnica de detección o bien a que correspondían a NTA muy incipientes (células aisladas y en un reducido porcentaje de túmulos en la mayoría de los casos).
Los hechos morfológicos y funcionales descritos en este trabajo sustentan la necesidad de determinar la expresión de PARP-1 en las biopsias de trasplante ante la sospecha de NTA dado su alto grado de correlación con la función renal inmediata.
AGRADECIMIENTOS
Queremos agradecer especialmente la contribución técnica de María Dolores Rodríguez, Francisca Sáez y Mercedes García-Román, técnicos del Departamento de Anatomía Patológica. Este trabajo ha sido financiado por el Fondo de Investigaciones Sanitarias (Proyecto PI051197).
BIBLIOGRAFÍA
de Murcia G, and Menissier de Murcia J. Poly(ADP-ribose) polymerase: a molecular nick-sensor. Trends Biochem Sci 1994; 19: 172-6.
Schraufstatter, IU, Hyslop PA, Hinshaw DB, Spragg RG, Sklar LA, Cochrane CG. Hydrogen peroxide-induced injury of cells and its prevention by inhibitors of poly(ADP-ribose) polymerase. Proc Natl Acad Sci USA 1986; 83: 4908-12.
Lindahl, T, Satoh MS, Poirier GG, Klungland A. Post-translational modification of poly(ADP-ribose) polymerase induced by DNA strand breaks. Trends Biochem Sci 1995; 20: 405-11.
Skaper SD. Poly(ADP-Ribose) polymerase-1 in acute neuronal death and inflammation: a strategy for neuroprotection. Ann N Y Acad Sc 2003; 993: 217-28.
Thiemermann, C, Bowes J, Myint FP, Vane JR. Inhibition of the activity of poly(ADP ribose) synthetase reduces ischemia-reperfusion injury in the heart and skeletal muscle. Proc Natl Acad Sci USA 1997; 94: 679-83.
Zhang, J, Dawson VL, Dawson TM, Snyder SH. Nitric oxide activation of poly(ADP-ribose) synthetase in neurotoxicity. Science 1994; 263: 687-9.
O’Valle F, Benítez MC, Gómez-Morales M, Bravo J, Osuna A, Del Moral RMG, Martín-Oliva D, Oliver FJ, Del Moral RG. Correlation of morphological findings with functional reserve in the aging donor: role of the poly (ADP-ribose) polymerase (PARP-1). Transplantation Procc 2004; 36: 733-5.
Virág L and Szabó C. The therapeutic potential of poly(ADP-Ribose) polymerase inhibitors. Pharmacol Rev 2002; 54: 375-429.
Chatterjee PK, Zacharowski K, Cuzzocrea S, Otto M, Thiemermann C. Inhibitors of poly (ADP-ribose) synthetase reduce renal ischemia-reperfusion injury in the anesthetized rat in vivo. FASEB J 2000; 14: 641-51.
Martin DR, Lewington AJ, Hammerman MR, Padanilam BJ. Inhibition of poly(ADP-ribose) polymerase attenuates ischemic renal injury in rats. Am J Physiol Regul Integr Comp Physiol 2000; 279: 1834-40.
Mangino JM, Ametani M, Szabó C, Southard LH. Poly(ADP-ribose) polymerase and renal hypothermic preservation injury. Am J Physiol Renal Physiol 2004; 286: 838-47.
Yelamos J, Oliver FJ: Role of poly (ADP-rribose) polimerase-1 (PARP-1) in the inflammatory response. Inmunología Dioc 2002; 21: 219-27.
Baliga R, N Ueda PD Walker, and SV Shah. Oxidant mechanisms in toxic acute renal failure. Am J Kidney Dis 1997; 29: 465-77.
Yu S, Wang H, Poitras MF, Coombs C, Bower S, el al. Ediation of Poly (ADP-ribose) polymerase-1 dependent cell death by apoptosis - inducing factor. Science 2002; 297: 259-63.
Noiri E, Nakao A, Uchida K, Tsukahara H, Ohno M, Fujita T, Brodsky S, Goligorsky MS.Oxidative and nitrosative stress in acute renal ischemia. Am J Physiol Renal Physiol 2001; 281: 948-57.
Soriano FG, Virag L, Szabo C. Diabetic endothelial dysfunction: role of reactive oxygen and nitrogen species production and poly (ADP-ribose) polymerase activation. J Mol Med 2001; 79: 437-48.
Perico N, Cattaneo D, Sayegh MH, Remuzzi G. Delayed graft function in kidney transplantation. Lancet 2004; 364: 1814-27.