
Vol. 39, n.º 4, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 4, 2006 |
ORIGINALES
José I. López1, Aitor Fernández de Larrinoa1, Rosa Zabala2, Laura Oleaga2, José L. del Cura2, Francisco J. Bilbao1
Hospital de Basurto. Universidad del País Vasco
(EHU/UPV). Bilbao.
1 Servicio de Anatomía Patológica.
2 Servicio de Radiología.
ilopez@hbas.osakidetza.net
RESUMEN
Antecedentes: La biopsia guiada por control ecográfico está siendo utilizada de manera creciente en los últimos años como aproximación diagnóstica inicial en los tumores renales, aunque su aceptación entre radiólogos y patólogos aún no es generalizada. Métodos: Durante un periodo de 6 años (2000-2005), se han biopsiado por este método y con agujas 18G un total de 48 tumores renales en 47 pacientes. Resultados: Se observó un predominio de varones (34V/13M) y la edad promedio se situó en 51,7 años (rango 1-92). Treinta y siete (77,1%) casos correspondieron a neoplasias, incluyendo adenocarcinomas renales (25 casos), oncocitomas (3 casos), linfomas (3 casos), tumores de Wilms (2 casos), un tumor carcinoide metastásico, un carcinoma epidermoide metastático, un nefroma quístico y un sarcoma fusocelular. Cinco casos (10,4%) correspondieron a pseudotumores (3 quistes renales y 2 pielonefritis crónicas). La biopsia proporcionó tejido renal normal en 4 casos y tejido fibroadiposo en 2. Se detectaron mínimas discrepancias en la adjudicación de la variante histológica del cáncer en 2 casos. Conclusiones: La biopsia cilindro guiada por ecografía es un método muy útil y fiable para el diagnóstico de los tumores renales, y debería ser incluida como herramienta de primera línea en su manejo. Sin embargo, para la obtención de óptimos resultados que puedan llevar a un tratamiento individualizado, se precisa una estrecha colaboración entre clínicos, radiólogos y patólogos.
Palabras clave: Biopsia cilindro, ecografía, adenocarcinoma renal, tumor renal, diagnóstico.
SUMMARY
Background: Ultrasound-guided core biopsy (USCB) has being increasingly used in the last years for diagnosis of renal masses. However, its use has not still reached a generalised acceptance among radiologists and pathologists. Methods: Over a 6-year period (2000-2005), a total of 48 renal masses in 47 patients were biopsied under ultrasound guidance using 18G needles. Results: Males predominated in the series (34M/13F), and the average age was 51.7 years (range 1-92). Thirty-seven (77.1%) cases were neoplasms. Diagnostic categories included renal cell carcinoma (25 cases), oncocytoma (3 cases), malignant lymphoma (3 cases), Wilms tumour (2 cases), carcinoid tumour, squamous cell carcinoma, metastatic, cystic nephroma, and spindle cell sarcoma (one each). Five cases (10.4%) were pseudotumours (3 renal cysts and 2 chronic pyelonephritides). The core biopsy obtained was normal renal tissue in 4 cases and fibroadipous tissue in 2. Minor discrepancies in the assignment of the histological variant were detected in 2 cases. Conclusions: Ultrasound-guided core biopsy is a very useful and reliable method in the diagnosis of renal masses and should be included as a first-line tool in its management. Close cooperation between clinicians, radiologists and pathologists is needed to obtain optimal results that may prompt an individualised treatment in every case.
Key words: Ultrasound, core biopsy, renal cell carcinoma, renal tumour, diagnosis.
INTRODUCCIÓN
La utilización de la punción biopsia guiada por control radiológico en el diagnóstico de las masas renales se ha visto incrementada en los últimos años pero aún no ha conseguido una aceptación generalizada. Debido fundamentalmente al avance en los métodos diagnósticos radiológicos, el número de tumores renales asintomáticos, menores de 3 cm, ha aumentado mucho en los últimos años. De hecho, la mayoría de los «incidentalomas» renales son adenocarcinomas de bajo estadio (1).
Los radiólogos, basándose en criterios bien establecidos, son capaces en la mayor parte de los casos de clasificar dichos tumores como benignos o malignos (2). Algunos de ellos, sin embargo, aún no pueden ser definidos con un mínimo de seguridad a pesar de utilizar las técnicas radiológicas más modernas. Hoy en día, los tumores renales más difíciles de diagnosticar son las lesiones quísticas complicadas, los pseudotumores (incluyendo las anomalías congénitas), los tumores no tratables con cirugía (por ejemplo los linfomas o las metástasis), y las lesiones de menos de 3 cm. de diámetro.
En estas circunstancias, la punción biopsia con control radiológico es una alternativa válida, barata, fiable y segura que ya ha demostrado su eficiencia en series previas tanto en la edad adulta (2-17) como en la infancia (18-20).
En este trabajo se presentan los resultados diagnósticos de una serie de 46 tumores abundando en su fiabilidad diagnóstica y en la ausencia de complicaciones reseñables debidas a la técnica.
MATERIAL Y MÉTODOS
Durante un período de 6 años (2000-2005), se han estudiado en el Hospital de Basurto mediante punción biopsia guiada por control ecográfico un total de 4.198 masas tumorales localizadas en una amplia variedad de órganos y topografías, tanto superficiales como profundas. De ellos, 48 (1,15%) correspondieron a masas renales que se descubrieron en 47 pacientes.
La técnica se realizó como aproximación diagnóstica inicial en el estudio de masas renales, o como método para el tratamiento posterior mediante ablación por radiofrecuencia. El estudio clínico incluyó una detallada historia clínica, analítica completa de sangre y orina, y un estudio radiológico completo (ecografía, TC, RM) en todos los pacientes (figs. 1 y 2). La toma de decisiones terapéuticas se realizó en el Comité de Tumores Urológicos del Hospital de Basurto en base al protocolo diseñado al efecto. Las biopsias se realizaron ante la existencia de dudas diagnósticas sobre la naturaleza de la lesión, antes de un procedimiento de ablación por radiofrecuencia, o en pacientes no candidatos a cirugía. Los pacientes fueron controlados a posteriori mediante técnicas de imagen para detectar posibles complicaciones y para valorar la respuesta individual a la ablación (fig. 3).
![]()
Fig. 1:
Imágenes Ecográficas. (A) Nefroma quístico. (B)
Tumor de Wilms. (C) Adenocarcinoma de células claras multiquístico.
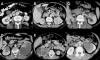
Fig. 2:
TC axial con contraste intravenoso de diferentes
ejemplos de masas renales. (A) Adenocarcinoma de células claras. Masa bien
definida con captación de contraste inferior al parénquima renal. (B)
Adenocarcinoma de células claras. Tumoración en polo superior de riñón izquierdo
heterogénea. (C) Oncocitoma. Lesión hipodensa en polo superior del riñón
izquierdo. (D) Metástasis de carcinoma epidermoide. Masas necróticas renales
bilaterales. (E) Tumor carcinoide. Tumoración heterogénea hipodensa en riñón
derecho. (F) Tumor de Wilms Tumoración en riñón izquierdo con invasión del seno
renal.
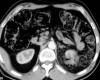
Fig. 3:
TC axial con contraste intravenoso. Oncocitoma
tratado con radiofrecuencia. Irregularidad del contorno del polo superior del
riñón izquierdo con imagen de aire en su interior y desflecamiento de la grasa
perirrenal.
La técnica consistió en punción percutánea con la técnica de «manos libres» en todos los casos. Se utilizó un transductor lineal de ultrasonidos de alta resolución (7-4 MHz) para guiar la aguja. Las biopsias se tomaron utilizando agujas automáticas BioPince® 18 G (Inter-V, Gainesville, FL, USA). Se obtuvieron entre 2 y 4 cilindros de tejido en cada caso, dependiendo de la accesibilidad de la lesión y la colaboración del paciente. Se inyectó anestesia local (lidocaina 1%) antes de realizar la punción para minimizar el dolor.
Los fragmentos de tejido se colocaron inmediatamente en suero fisiológico refrigerado para retardar lo más posible la autolisis y se remitieron al Servicio de Anatomía Patológica para su procesamiento. En el Laboratorio se realizaron improntas citológicas con los cilindros que se tiñeron con hematoxilina-eosina, y se centrifugó el suero de transporte para obtener botones celulares que se tiñeron con Papanicolaou. Los cilindros se fijaron en formol, se incluyeron en parafina, y se procesaron de manera rutinaria.
RESULTADOS
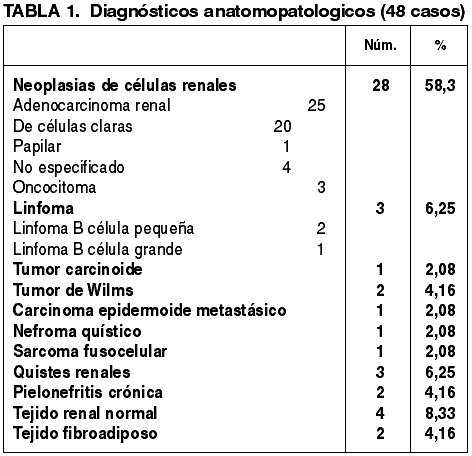
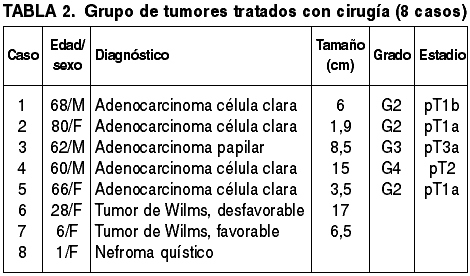
Se han detectado 37 neoplasias, lo cual supone algo más del 75% de los casos, y 5 lesiones pseudotumorales. El listado de diagnósticos histológicos en la serie aparece reflejado en la tabla 1. Se observa un claro predominio del sexo masculino (34 varones y 13 mujeres). El rango de edades en la serie es muy amplio, de 1 a 92 años, con una media de 51,7 años. Los tumores afectaron por igual al riñón derecho (25 casos) y al izquierdo (23 casos). En un paciente se puncionaron ambos riñones. En 8 casos se practicó nefrectomía (tabla 2), y en 12 se realizó tratamiento ablativo mediante radiofrecuencia (tabla 3). En el resto de los pacientes, en función de la estadificación del tumor y de la situación clínica del enfermo, se realizaron tratamientos médicos con intención curativa (quimioterapia, inmunoterapia, radioterapia, antibioterapia), o tratamientos paliativos.
Se detectaron discrepancias diagnósticas menores entre la biopsia y la pieza quirúrgica en 2 casos, siempre debido a la escasez de tumor en la muestra, y en un caso el muestreo no obtuvo tejido tumoral (tabla 4).

En ningún caso se observaron complicaciones reseñables relacionadas con el procedimiento.
Adenocarcinoma (25 casos)
La mayoría de los casos correspondieron a adenocarcinomas de células claras (21/25) (fig. 4), aunque uno de ellos fue finalmente etiquetado como adenocarcinoma papilar en la pieza de nefrectomía. En 4 casos solo se pudo llegar al diagnóstico de adenocarcinoma debido a la escasez de tumor en la muestra y la falta de características histológicas definitorias del tumor. En 5 casos se practicó nefrectomía radical y en 9 casos ablación por radiofrecuencia.
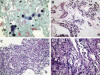
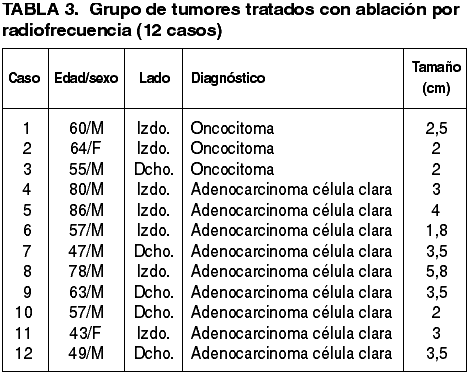
Fig. 4:
Adenocarcinoma de células claras. (A) El
centrifugado del líquido de transporte proporciona grupos celulares epiteliales
de elementos poligonales, con citoplasmas amplios y claros, y atipia nuclear.
(B) Imagen histológica con escaso número de células malignas de bajo grado y en
la que predomina el edema. (C) Crecimiento sólido con células claras y
granulares. (D) Detalle citológico formando nidos y pequeñas luces.
La mayoría de los casos no plantearon problemas diagnósticos. En muchos de ellos se advirtió el característico color amarillento del adenocarcinoma de células claras en el examen macroscópico de los cilindros. Tanto en la impronta citológica como en el citocentrifugado las células tumorales aparecieron en pequeños grupos o de forma suelta, y mostraron un citoplasma amplio y claro, y un núcleo cromático central con ocasionales nucleolos. Los cortes histológicos mostraron la típica morfología de estos tumores, con grupos sólidos, cordones, o estructuras alveolares de células claras. Los mayores problemas surgieron por la fragmentación del tumor, y por la necrosis y/o hemorragia acompañante, que dificultó en ocasiones la identificación tumoral.
Oncocitoma (3 casos)
Los 3 casos en este grupo fueron tumores de pequeño tamaño, menores de 3 cm, en los estudios radiológicos y fueron puncionados con una doble intención, diagnóstica por un lado, y terapéutica mediante ablación por radiofrecuencia por otro.
Estos tumores mostraron en todos los casos su histología típica (fig. 5) y, aunque el muestreo tumoral fuera en ocasiones escaso, la identificación de células de morfología poliédrica, con amplio citoplasma intensamente eosinófilo y granular y núcleos cromáticos regulares, formando pequeños nidos sólidos en un estroma fibroso o edematoso, no supuso un gran problema diagnóstico. Las células fueron negativas con la técnica de hierro coloidal.
![]()
Fig. 5:
Oncocitoma renal. (A) Crecimiento tumoral
formando nidos sólidos de células de citoplasma eosinófilo granular inmersos en
un estroma laxo. (B) Detalle citológico con citoplasma amplio, granular,
intensamente eosinófilo, típicamente oncocitario.
Linfoma (3 casos)
Se identificaron 2 linfomas de célula pequeña y uno de célula grande, todos ellos de tipo B (fig. 6). En todos los casos se trató de la expresión renal de una enfermedad sistémica, y se trataron conforme a los protocolos apropiados.
![]()
Fig. 6:
Linfoma folicular. (A) Crecimiento neoplásico
difuso de células pequeñas invadiendo el parénquima renal. (B) Detalle
citológico de los linfocitos neoplásicos. (C) Intensa positividad para CD20.
Tumor de Wilms (2 casos)
El primer caso correspondió a una gran masa de 15 cm localizada en la fosa renal izquierda en una paciente de 28 años de edad. En la biopsia se identificó una neoplasia altamente indiferenciada y maligna, compuesta por células pequeñas con alto índice mitótico, sin patrón de crecimiento definible. El estudio inmunohistoquímico detectó únicamente positividad para CD99 y el diagnóstico inicial fue Ewing/PNET. Le resección quirúrgica demostró que la neoplasia dependía del riñón aunque afectaba a las partes blandas perirrenales. El estudio histológico exhaustivo de la pieza mostró áreas blastemales y epiteliales, aunque la mayor parte del tumor estaba compuesto por elementos estromales malignos con intensa anaplasia. Se etiquetó de tumor de Wilms de histología desfavorable, E2 (fig. 7).
![]()
Fig. 7:
Tumor de Wilms. (A) Zona blastemal con artefacto
nuclear típico secundario a la punción. (B) Positividad de membrana para CD99.
El segundo caso correspondió a una masa renal de 6,5 cm en una niña de 6 años de edad. La punción biopsia no obtuvo tejido tumoral. La resección quirúrgica mostró un tumor de Wilms típico, con sus 3 componentes básicos, sin anaplasia.
Miscelánea (4 casos)
Tumor carcinoide bien diferenciado (fig. 8) en un contexto clínico de enfermedad metastásica sin origen conocido, con histología cordonal típica, compuesto por células cuboideas con amplio citoplasma granular que resultaron intensamente positivas con cromogranina y sinaptofisina.
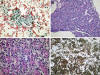
Fig. 8:
Metástasis de tumor carcinoide. (A) Placa
citológica compuesta por células poligonales monomorfas, con citoplasma
granujiento y núcleo cromático central. (B) Crecimiento neoplásico formando
cordones e imágenes rosetoides entre bandas de estroma colágeno. (C) Detalle
citológico mostrando células de morfología cuboidea con núcleos regulares, sin
atipia. (D) Postividad intensa para cromogranina.
Carcinoma epidermoide bien diferenciado (fig. 9) en un paciente diagnosticado 4 años antes de carcinoma epidermoide de la cavidad oral, que fue tratado con cirugía y radioterapia. Se realizó tratamiento paliativo.
Fig. 9:
Metástasis de carcinoma epidermoide. (A) Cordones
de células malignas inmersos en un estroma desmoplásico. (B) Nido sólido tumoral
englobando un glomérulo. (C) Atipia citológica y diferenciación escamosa. (D)
Positividad para CK 5.6.
Sarcoma fusocelular de alto grado de malignidad invadiendo el riñón derecho y afectando a las partes blandas perirrenales. El tumor fue repetidamente negativo con una amplia batería de queratinas. Se realizó tratamiento paliativo.
Nefroma quístico de histología típica en una niña de 1 año de edad. La sospecha radiológica fue confirmada en la punción, que obtuvo pequeños fragmentos de tejido incluyendo pared quística y estroma metaplásico. La cirugía posterior confirmó el diagnóstico.
Pseudotumores (5 casos)
Tres quistes renales simples que fueron puncionados para descartar la sospecha de adenocarcinoma renal predominantemente quístico. En todos los casos se observó una pared fibrosa con restos inflamatorios crónicos sin evidencia de malignidad epitelial. El seguimiento radiológico de los casos no ha demostrado recidivas ni masas tumorales subsiguientes.
Dos pielonefritis crónicas que simularon radiológicamente tumores renales. La biopsia mostró inflamación crónica y cambios reactivos no tumorales en ambos casos. No se detectó transformación xantogranulomatosa en ninguno de los casos, aunque el muestreo fue necesariamente limitado, ni tampoco signos de malignidad. Se realizó tratamiento médico en ambos casos.
DISCUSIÓN
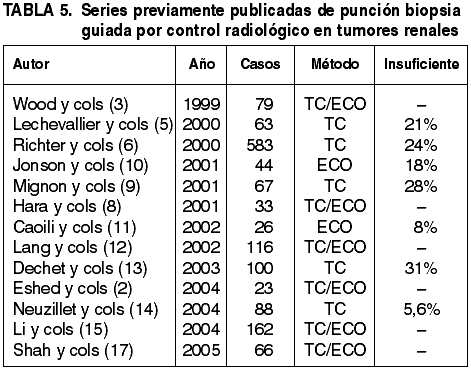
Las indicaciones para llevar a cabo una biopsia guiada por control radiológico en tumores renales no están bien definidas y su realización está más relacionada con la disponibilidad y costumbre de urólogos y radiólogos, que con reglas de procedimiento previamente protocolizadas e internacionalmente asumidas. En principio, se admite que todos los pacientes con contraindicación para la cirugía, casos en los que se sospeche enfermedad metastásica en el riñón, pacientes monorrenos, y casos con tumores múltiples bilaterales, serían candidatos perfectos para este método diagnóstico (2). A ello hay que añadir las masas renales que los radiólogos califican como indeterminadas, es decir, aquellas en las que las técnicas más modernas aún no son capaces de discernir entre situaciones con muy distinto tratamiento y pronóstico. En los últimos años se ha añadido una nueva indicación: la tipificación de las masas renales que pueden ser sometidas a ablación por radiofrecuencia. En cuanto al método radiológico para guiar la aguja, de nuevo hay que hablar de las preferencias de cada radiólogo, aunque la mayor inocuidad de la ecografía frente a la tomografía, junto con los datos que apuntan que ambas formas ofrecen resultados similares (2), aconseja el uso de la primera siempre que sea posible. Richter y cols. estudiaron 245 biopsias guiadas por tomografía en un periodo de 29 años y seleccionaron para punción sólo las masas renales sólidas y los quistes complejos (6). Otros autores incluyen a los tumores de menos de 3 cm de diámetro como potenciales beneficiarios de esta técnica, aunque Lechevallier y cols. (5) encuentran una menor eficacia diagnóstica en tumores pequeños (£3 cm) que en grandes en una serie de 63 casos.
Existen muy pocos trabajos que se aproximen al problema desde el punto de vista del patólogo (17, 21), pero demuestran que la información proporcionada influye decisivamente en las decisiones terapéuticas. Como resulta obvio, el diagnóstico histológico de un tumor muy grande con un trozo del mismo muy pequeño no está exento de riesgos. Las mayores dificultades diagnósticas aparecen al tratar de distinguir los oncocitomas y la variante eosinofílica de los carcinomas de células cromófobas (17). La fiabilidad diagnóstica es, no obstante, muy alta, alcanzando en algunas series una sensibilidad y especificidad que rondan (2) o alcanzan (11) el 100%.
La necrosis tumoral es un hallazgo frecuente en los tumores renales, sobre todo en los de gran tamaño o en los de rápido crecimiento. Suele ser un hallazgo que los radiólogos pueden llegar a identificar, evitando la punción en esas áreas. No obstante, como regla general, es conveniente dirigir la aguja hacia las zonas periféricas del tumor ya que el riesgo de obtener tejido necrótico o hemorrágico es mucho menor en ellas. En condiciones normales, el diagnóstico del carcinoma de células claras en cilindros biopsia no plantea demasiados problemas. Incluso en la impronta citológica y en el citocentrifugado se pueden identificar las células neoplásicas en pequeños grupos tridimensionales con escasa cohesividad. Esta característica ayuda a distinguirlos de los histiocitos. Existen aproximaciones exclusivamente citológicas al problema (23-27), incluso aplicando técnicas de citometría de flujo (28) pero su fiabilidad diagnóstica es menor (10) y el esfuerzo y la asunción de riesgos prácticamente similar, por lo cual no se ha impuesto como método de primera elección. La técnica no está exenta de fallos a la hora de obtener material válido para el diagnóstico. Las cifras oscilan entre el 5,6% ofrecido por Neuzillet y cols (14) y el 31% por Dechet y cols. (13), motivo por el cual estos últimos autores desaconsejan su uso. En nuestra serie, el 13,9% de las punciones proporcionaron material insuficiente para el diagnóstico.
Es de destacar el amplio abanico de lesiones encontradas por este método en una serie no demasiado larga como la presentada en este trabajo (tabla 1), lo cual es un argumento más a añadir a los ya existentes para aconsejar su realización dentro de un protocolo consensuado entre urólogos, radiólogos, y patólogos. Así, quistes renales, carcinomas, oncocitomas, tumores propios de la edad pediátrica, pielonefritis, metástasis, linfomas, etc, han podido ser caracterizados histológicamente y tratados consecuentemente en función de la estadificación y de otros parámetros clínicos.
Toda la literatura analizada insiste en la práctica ausencia de complicaciones reseñables relacionadas con la punción (2,8,11,14,16). Se mencionan los hematomas subcapsulares como las complicaciones más frecuentes, pero no requieren en si mismas actuaciones específicas.
Son varios los trabajos que insisten en que el diagnóstico de la punción biopsia cambia la actitud terapéutica (3,6,15). La crioterapia o la ablación mediante radiofrecuencia son dos formas modernas de tratamiento especialmente eficaces en tumores menores de 4 cm. Su mayor indicación está en pacientes con alto riesgo quirúrgico, en tumores múltiples, o en pacientes monorrenos (22). En nuestra experiencia con 12 casos, los resultados han sido satisfactorios en todos ellos, y los pacientes se encuentran libres de enfermedad en el último control.
En conclusión, y a pesar de discrepancias puntuales, la biopsia obtenida por control ecográfico es un método barato, rápido, y fiable de aproximarse al diagnóstico de las masas renales. Su utilización sistemática dentro de un protocolo como el propuesto por Shah y cols (17) sólo reportará beneficios al enfermo, aunque exigirá una estrecha colaboración clínico-patológica y una cierta experiencia si se esperan unos resultados óptimos.
BIBLIOGRAFÍA
Rendon RA, Stanietzky N, Panzarella T, Robinette M, Klotz LH, Thurston W, et al. The natural history of small renal masses. J Urol 2000; 164: 1143-7.
Eshed I, Elias S, Sidi AA. Diagnostic value of CT-guided biopsy of indeterminate renal masses. Clin Radiol 2004; 59: 262-7.
Wood BJ, Khan MA, McGovern F, Harisinghani M, Hahn PF, Mueller PR. Imaging guided biopsy of renal masses: Indications, accuracy and impact on clinical management. J Urol 1999; 161: 1470-4.
Barriol D, Lechevallier E, Andre M, Daniel L, Ortega JC, Rossi D, et al. CT-guided percutaneous fine needle biopsy of solid tumors of the kidney. Prog Urol 2000; 10: 1145-51.
Lechevallier E, André M, Barriol D, Daniel L, Eghazazian C, De Fromont M, et al. Fine-needle percutaneous biopsy of renal masses with helical CT guidance. Radiology 2000; 216; 506-10.
Richter F, Kasabian NG, Irwin RJ Jr, Watson RA, Lang EK. Accuracy of diagnosis by guided biopsy of renal mass lesions classified indeterminate by imaging studies. Urology 2000; 55: 348-52.
Daniel L, Barriol D, Lechevallier E, André M, De Fromont M, Charafe E, et al. Diagnostic value of percutaneous biopsy of the renal masses. 73 cases. Ann Pathol 2000, 20: 119-23.
Hara I, Miyake H, Hara S, Arakawa S, Hanioka K, Kamidono S. Role of percutaneous image-guided biopsy in the evaluation of renal masses. Urol Int 2001; 67: 199-202.
Mignon F, Mesurolle B, Ariche-Cohen M, Vanel D. Value of CT guided renal biopsies: retrospective review of 67 cases. J Radiol 2001; 82: 907-11.
Johnson PT, Nazarian LN, Feld RI, Needleman L, Lev-Toaff AS, Segal SR, et al. Sonographically guided renal mass biopsy: indications and efficacy. J Ultrasound Med 2001; 20: 749-53.
Caoili EM, Bude RO, Higgins EJ, Hoff DL, Nghiem HV. Evaluation of sonographically guided percutaneous core biopsy of renal masses. AJR 2002; 179: 373-8.
Lang EK, Macchia RJ, Gayle B, Richter F, Watson RA, Thomas R, et al. CT-guided biopsy of indeterminate renal cystic masses (Bosniak 3 and 2F): accuracy and impact on clinical management. Eur Radiol 2002; 12: 2518-24.
Dechet CB, Zincke H, Sebo TJ, King BF, LeRoy AJ, Farrow GM, et al. Prospective analysis of computerized tomography and needle biopsy with permanent sectioning to determine the nature of solid renal masses in adults. J Urol 2003; 169: 71-4.
Neuzillet Y, Lechevallier E, Andre M, Daniel L, Coulange C. Accuracy and clinical role of fine needle percutaneous biopsy with computerized tomography guidance of small (less than 4.0 cm) renal masses. J Urol 2004; 171: 1802-5.
Li G, Cuilleron M, Gentil-Perret A, Tostain J. Characteristics of image-detected solid renal masses: implication for optimal treatment. Int J Urol 2004; 11: 63-7.
Wunderlich H, Hindermann W, Al Mustafa AM, Reichelt O, Junker K, Schubert J. The accuracy of 250 fine needle biopsies of renal tumors. J Urol 2005; 174: 44-6.
Shah RB, Bakshi N, Hafez KS, Wood DP, Kunju LP. Image-guided biopsy in the evaluation of renal mass lesions in contemporary urological practice: indications, adequacy, clinical impact, and limitations of the pathological diagnosis. Hum Pathol 2005; 36: 1309-15.
Sköldenberg EG, Jakobson A, Elvin A, Sandstedt B, Läckgren G, Christofferson RH. Pretreatment, ultrasound-guided cutting needle biopsies in childhood renal tumors. Med Pediatr Oncol 1999; 32: 283-8.
Sköldenberg EG, Jakobson A, Elvin A, Sandstedt B, Olsen L, Christofferson RH. Diagnosing childhood tumors: A review of 147 cutting needle biopsies in 110 children. J Pediatr Surg 2002; 37: 50-6.
Vujanic GM, Kesley A, Mitchell C, Shannon RS, Gornall P. The role of biopsy in the diagnosis of renal tumors of childhood: Results of the UKCCSG Wilms Tumor Study 3. Med Pediatr Oncol 2003; 40: 18-22.
Harik L, Pashaei S, Humphrey P, et al. Needle core biopsy of the kidney for mass lesions: a clinicopathologic study perspective based on 196 cases. Mod Pathol 2005; 18: 144A.
Tacke J, Mahnken AH. Percutaneous radiofrequency ablation of renal cell cancer. Radiologe 2004; 44: 358-63.
Pilotti S, Rilke F, Alasio L, Garbagnati F. The role of fine needle aspiration in the assessment of renal masses. Acta Cytol 1988; 32: 1-10.
Truong LD, Todd TD, Dhurandhar B, Ramzy I. Fine-needle aspiration of renal masses in adults: Analysis of results and diagnostic problems in 108 cases. Diagn Cytopathol 1999; 20: 339-49.
Al Nazer M, Mourad WA. Succesful grading of renal-cell carcinoma in fine-needle aspirates. Diagn Cytopathol 2000; 22: 223-6.
Brierly RD, Thomas PJ, Harrison NW, Fletcher MS, Nawrocki JD, Ashton-Key M. Evaluation of fine-needle aspiration cytology for renal masses. BJU Int 2000; 85: 14-8.
Liu J, Fanning CV. Can renal oncocytomas be distinguished from renal cell carcinoma on fine-needle aspiration specimens? A study of conventional smears in conjunction with ancillary studies. Cancer Cytopathol 2001; 93: 390-7.
Ljungberg B, Stenling R, Roos G. Flow cytometric DNA analysis of renal-cell carcinoma. A study of fine needle aspiration biopsies in comparison with multiple surgical samples. Anal Quant Cytol Histol 1987; 9: 505-8.