
Vol. 39, n.º 3, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 3, 2006 |
ORIGINALES
Francisco Javier Torres Gómez1, Francisco Javier Torres Olivera2
1 Servicio de
Anatomía Patológica. Hospital Punta de Europa. Algeciras (Cádiz).
2 Departamento de Anatomía Patológica. Hospital Universitario Virgen
Macarena. Sevilla.
RESUMEN
Introducción: El carcinoma ductal infiltrante es un tumor dependiente de la angiogénesis para aumentar su tamaño y metastatizar. Hemos establecido la correlación entre la densidad vascular tumoral y los factores pronósticos con expresión inmunohistoquímica. Material y métodos: Se ha determinado la densidad vascular tumoral sobre el mejor punto caliente en un campo microscópico a 400x y se ha determinado inmunohistoquímicamente la expresión de receptores estrogénicos, p53 y c-erb2 en cada una de las 165 pacientes con carcinoma ductal infiltrante (NOS). Resultados: No hemos obtenido correlación significativa entre la expresión de receptores estrogénicos, p53 y c-erb2 y la densidad vascular en el carcinoma ductal infiltrante de mama.
Palabras clave: Carcinoma ductal infiltrante, angiogénesis, receptores estrogénicos, p53, c-erb2.
SUMMARY
Introduction: Invasive ductal carcinoma of the breast is an angiogenesis dependent tumour in order to growth and metastatize. We have correlate tumoral vascular density and the different prognostic factors with immunohistochemical expression. Material and methods: We have calculated the tumoral vascular density in the best hot spot using a 400 x microscopic field and settling immunohistochemically the estrogen receptors, p53 and c-erb2 expression in each of the 165 patients with invasive ductal carcinoma. Results: We have not demonstrated significant correlation between estrogen receptor, p53 and c-erb2 expression and the vascular density in the invasive ductal carcinoma of the breast.
Keywords: Invasive ductal carcinoma, angiogenesis, estrogen receptors, p53 and c-erb2.
INTRODUCCIÓN
El sistema vascular es el resultado de la combinación de dos procesos: vasculogénesis (formación de novo de vasos sanguíneos a partir de los angioblastos mesodérmicos) y angiogénesis (proceso complementario del primero en el que se forman neovasos a partir de los ya existentes por proliferación y migración de las células endoteliales). La angiogénesis controlada es un proceso fundamental en diferentes acontecimientos fisiológicos y supone un equilibrio delicado entre estimuladores e inhibidores angiogénicos. La angiogénesis no regulada es un factor decisivo en la evolución de algunas enfermedades (retinopatía diabética, psoriasis, etc…) y un requisito imprescindible para el crecimiento de las neoplasias (1-3), siendo decisiva su intervención en el mecanismo de la invasión tumoral, diseminación metastásica (3-7) y en el crecimiento de los depósitos metastásicos (7-9). Numerosas evidencias sostienen que el carcinoma mamario es un tumor dependiente de la angiogénesis (2-4,8,10,11), siendo esta demostrada en sus estadios precoces (12-15). Se ha correlacionado la densidad vascular intratumoral en el carcinoma de mama con el tamaño tumoral, grado histológico, estatus ganglionar axilar, con el número de ganglios axilares afectados (16-19) y supervivencia (7,20), lo que apoya su valor como factor pronóstico (4,7,9,19,20-24). Las referencias a la correlación entre la angiogénesis y la expresión inmunohistoquímica en el cáncer de mama son escasas y poco concluyentes, lo que ha estimulado la orientación del presente trabajo.
MATERIAL Y MÉTODOS
Se han estudiado retrospectivamente 165 casos de carcinoma ductal infiltrante clásico. En todos ellos conocemos el tamaño tumoral, el grado histológico combinado, el estatus ganglionar axilar y el número de ganglios afectados. En cada uno de los casos se ha realizado estudio inmunohistoquímico frente a los antígenos CD 31 (monoclonal, dilución 1:50), p53 (monoclonal, no diluido), c-erb2 (monoclonal no diluido) (Concepta Byosistems S.A., Barcelona) y antireceptores estrogénicos (dilución 1:40) (Novocastra Lab. Ltd U.K. ) en un procesador automático VENTANA ES (Ventana Medial Systems, Tucson, Arizona, USA) empleando el conjunto de detección Ventana Enhanced DAD (Solución inhibidora de peróxido de hidrógeno, anticuerpo biotinilado antiratón, solución de peróxido de hidrógeno, DAD, solución de sulfato de cobre, hematoxilina y contraste de fondo). El desenmascaramiento antigénico se ha realizado mediante tampón citrato a Ph 6, en olla a presión durante 4 minutos. En los cortes histológicos teñidos con HE se ha determinado nuevamente el grado histológico combinado de Nottingam (45) a fin de eliminar posibles variaciones interobservadores.
La determinación de la angiogénesis se ha realizado sobre el mejor punto caliente (zona de mayor densidad vascular) en un campo microscópico de 0,229 mm2 a 400 aumentos (25). La expresión de receptores estrogénicos (RE) se ha valorado según el porcentaje de células teñidas y la intensidad de la tinción. La expresión de p53 en las células tumorales se ha reflejado en resultado positivo o negativo. La expresión de c-erb2 se ha considerado positiva fuerte cuando se ha apreciado tinción completa de la membrana celular en más del 10% de las células neoplásicas, positiva débil cuando la tinción ha sido débil o incompleta en más del 10% de las células tumorales y negativa cuando la tinción de membrana ha sido negativa o cuando menos del 10% de las células han resultado positivas (26).
El análisis estadístico se ha realizado con el programa SPSS versión 1,2 para Windows. En el caso de análisis de variables cualitativas o cuantitativas agrupadas en intervalos se han calculado las Tablas de Contingencia u Homogeneidad con el Test de la Chi-Cuadrado o en el caso de Tablas 2 ¥ 2, con la corrección de continuidad. En el caso de comparación de variables cuantitativas según los grupos que establece una variable cualitativa, hemos utilizado el Análisis de la Varianza (ANOVA) y en supuesto de obtener diferencias significativas hemos utilizado el Test de Comparaciones Múltiples de Bonferroni.
RESULTADOS
Las densidades vasculares total (DVT) y media (DVM) obtenida en las series con distinta expresión de RE se reflejan en la tabla 1. La distribución de los recuentos vasculares por intervalos queda reflejada en la tabla 2.


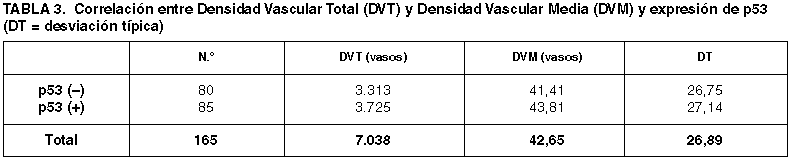
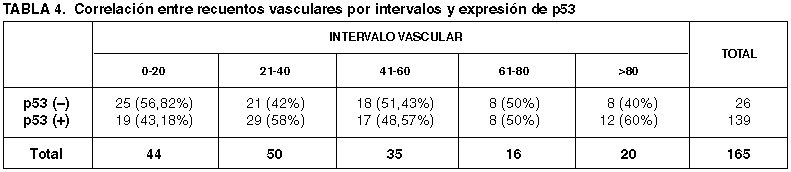
Las DVT y DVM obtenida en las series con distinta expresión de p53 quedan reflejadas en la tabla 3. La distribución de los recuentos vasculares por intervalos queda reflejada en la tabla 4.
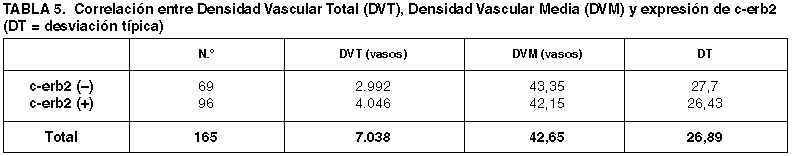
Las DVM y DVM obtenidas en las series de casos con distinta expresión de c-erb2 quedan reflejadas en la tabla 5. La distribución de los recuentos vasculares por intervalos quedan reflejados en la tabla 6.

DISCUSIÓN
Aunque la DVM obtenida en los casos sin expresión de RE es ligeramente superior a la obtenida en la serie con expresión positiva de los mismos, la diferencia no es estadísticamente significativa (p=0,058) y la falta de correlación aumenta cuando se establecen intervalos en el recuento vascular (p=0,485). Estos resultados coinciden con los de otros autores (27).
Algunos trabajos defienden el valor predictivo independiente de supervivencia de la sobreexpresión de p53 (81,109,185), mientras otros le niegan cualquier valor pronóstico (22). La alteración de p53 provoca la pérdida de regulación de la trombospodina-1, un potente inhibidor de la angiogénesis, y un incremento de la expresión del factor vascular del factor de crecimiento endotelial (VEFG), un factor proangiogénico (28). Ambos hechos sugieren un aumento de la actividad angiogénica relacionada con la mutación de p53. Las DVM obtenidas en las series con distinta expresión de p53 en nuestro estudio no muestran diferencias significativas (p=0,568) que permitan corroborar esta hipótesis. La similitud de las DVM obtenidas en ambas series se mantienen cuando se aplican intervalos vasculares en su determinación (p=0,596). Otros autores por el contrario relacionan una menor DV con la sobreexpresión de p53 (29).
Tampoco hemos obtenido diferencias significativas entre las DVM obtenidas en las series con diferente expresión de c-erb2 (p=0,778) y estos resultados se mantienen cuando aplicamos intervalos al recuento vascular (p=0,585). Sin embargo, otros autores encuentran una relación significativa entre una DV alta y una expresión positiva de c-erb2 modulada por la maspina, un factor relacionado con la migración celular, apoptosis y angiogénesis en el cáncer mamario (30).
Los resultados obtenidos parecen indicar que no existe una relación evidente entre la expresión de RE, p53 y c-erb2 y la angiogénesis en el carcinoma ductal infiltrante de mama.
BIBLIOGRAFÍA
Folkman J, Klagsbrun M. Angiogenic factors. Science 1987; 235, 442-7.
Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med 1971; 285: 1182-6.
Guinebretiere J. Angiogenesis and breast neoplasm. The pathologist-s point of view. Gynecol Obstet Fertil 2005; 33: 140-6.
Gasparini G. Clinical significance of determination of surrogate markers of angiogenesis in breast cancer. Crit Oncol Hematol 2001; 37: 97-114.
Tanigawa N, Amaya H, Matsumura M et al. Tumor angiogenesis and mode of metastasis in patients with colorectal cancer. Cancer Res 1997; 57: 1043-6.
Urh J, Schenermann R, Steet N et al. Cancer dormancy: opportunities for new therapeutic approaches. Nature Med 1997; 505-9.
Heimann R, Fergurson D, Powers C y cols. Angiogenesis as a predictor of long-term survival for patients with node-negative breast cancer. Br J Biomed Sci 1998; 3: 214-20.
Vartanian R, Weidner N. Correlation of intratumoral endothelial cell proliferation with microvessel density (tumor angiogenesis) and tumor cell proliferation in breast carcinoma. Am J Pathol 1994; 1444: 1188-94.
Weidner N. The relationship of tumor angiogenesis and metastasis with emphasis on invasive breast carcinoma. Adv Pathol Lab Med 1992; 5: 101-21.
Edel M, Harvey J, Papadimitriou J. Comparison of vascularity and angiogenesis in primary invasive mammary carcinomas and in their respective axillary lymph node metastasis. Clin Exp Metastasis 2000; 18: 695-702.
Rak J, Filmus J, Kerbel R. Reciprocal paracrine interactions between tumor cells and endothelial cells: the «angiogenic progression» hypothesis. Eur J Cancer 1996; 32: 2438-50.
Engels K, Fox S, Withehouse R et al. Up-regulation of thimidine phosfolylase expression is associated with a discrete pattern of angiogenesis in ductal carcinoma in situ of the breast. J Pathol 1997; 4: 414-20.
Heffelfinger S, Yassin R, Miller M y cols. Vascularity of proliferative breast disease and carcinoma in situ correlates with histological features. Clin Cancer Res 1996; 11: 1873-8.
Santinelli A, Baccarini M, Colanzi P et al. Microvessel quantification in intraductal and early invasive breast carcinoma. Analyt Quant Cytol Histol 2000; 2: 277-84.
Zolota V, Gerokosta A, Melachrinou M et al. Microvessel density, proliferating activity, p53 and bcl-2 expression in in situ ductal carcinoma of the breast. Anticancer Res 1999; 19: 3269-74.
Fox S, Leek R, Weekes M et al. Quantitation and prognostic value of breast cancer angiogenesis: comparison of microvessel density, Chalkey count and computer image analisis. J Pathol 1995; 177: 275-83.
Fox B, Gatter K, Harris. Tumor angiogenesis. J Pathol 1996; 179: 232-7.
Jiang X, Huang X, Li J. The correlation between tumor angiogenesis and lymph node metastasis in primary breast carcinoma. Zhonghua Wai Ke Za Zhi 1997; 35: 583-5.
Laforga J, Aranda F. Angiogenic index: a new method for assessing microvascularity in breast carcinoma with possible prognostic implications. Breast J 2000; 6: 103-7.
Heimann R, Hellman S. Individual characterisation of the metastatic capacity of human breast carcinoma. Eur J Cancer 2000; 36: 1631-9.
Bossari S, Lee A, De Lellis R et al. Microvessels quantitation and prognosis in invasive breast carcinoma. Hum Pathol 1992; 23: 755-61.
Erden O, Dursun A, Loskun U y cols. The pronostic value of p53 and c-erb2 expresion, proliferative activity and angiogenesis in node – negative breast carcinoma. Tumori 2005; 91: 46-52.
Weidner N, Semple J, Welch W et al. Tumor angiogenesis and metastasis correlation in invasive breast carcinoma. N Engl J Med 1991; 324: 1-8.
Weidner N. Tumoral vascularity as a prognostic factor in cancer patients: the evidence continues to grow. J Pathol 1998; 2, 130-5.
Torres Gómez FJ, Torres Olivera FJ. Estudio comparativo de diferentes métodos de recuento vascular. Revista Española de Patología (en prensa).
Ridolfi R, Jamenhdor M, Arber J. Her-2/neu testing in breast carcinoma: a combined immunohistochemical and fluorescence in situ hibridation approach. Mod Pathol 2000; 13: 866-73.
Xiao J, Yu X, Xu X y cols. Relation between angiogenesis, fibrinolisis and invasión in metastasis of breast cancer. Zonghua Zhong Lin Za Zhi 2005; 27: 226 -8.
Linderholm B, Lindh B, Tavelin B et al. p53 and vascular endothelial growth factor (VEGF) expression predicts outcome in 833 patients with primary breast carcinoma. Int J Cancer 2000; 89: 51-62.
Pendleton N, Pazouki S, Heerkense E y cols. Relationship between different measurements of vascularity and clinico-pathological parameters in breast cancer. Anticancer Res 1998; 68: 4565-8.
Sopel M, Kasprzyk I, Berdowska I. Maspin and cerb2 expression in correlation with microvessel density in invasive ductal breast cancer. Folia Histoch Cytobiol 2005; 43: 109-16.