
Vol. 39, n.º 3, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 3, 2006 |
ORIGINALES
Carmen Etxezarraga, José Ignacio López
Servicio de Anatomía Patológica. Hospital de
Basurto. Universidad del País Vasco (EHU/UPV). Bilbao.
* Este trabajo ha sido presentado de manera parcial en el 95th USCAP Annual
Meeting, Atlanta, GA, USA, del 11-17 febrero de 2006 (poster n.º 620).
ilopez@hbas.osakidetza.net
RESUMEN
Antecedentes: El carcinoma diminuto es un hallazgo común el las biopsias transrectales de próstata. Su significado es equívoco para el urólogo debido a que su identificación no implica necesariamente que la enfermedad esté confinada en la próstata ni que su índice de Gleason sea bajo. Métodos: Durante un periodo de 8 años (1998-2005) se han realizado un total de 46 prostatectomías radicales en pacientes cuyas biopsias previas contenían un adenocarcinoma diminuto, definido éste como un solo foco de cáncer de 0,5 mm o menos en toda la biopsia. Esto supone un 12,67% de los casos en nuestro material. Este hallazgo ha sido evaluado histológicamente en las biopsias transrectales y correlacionado con datos relevantes en las correspondientes prostatectomías radicales (grado de extensión tumoral, índice de Gleason, PIN de alto grado, invasión perineural, extensión extraprostática, y estado de los márgenes quirúrgicos). Resultados: Los datos histológicos más frecuentes que caracterizan al carcinoma diminuto son: índice de Gleason £7 (43/46), agrandamiento nuclear (41/46), patrón infiltrante (41/46), presencia de nucleolo (41/46), PIN de alto grado (27/46), secreciones intraglandulares (26/46), y cristaloides (22/46). Se observó una correlación evidente con el grado de extensión tumoral y con el índice de Gleason. Los márgenes positivos y la invasión perineural y del ápex también fueron hallazgos frecuentes. Conclusiones: El carcinoma diminuto es un hallazgo frecuente en las biopsias transrectales de próstata y puede estar asociado a parámetros de mal pronóstico en las prostatectomías radicales.
Palabras Clave: Adenocarcinoma de próstata, criterios histológicos, biopsia transrectal, prostatectomía radical, pronóstico.
SUMMARY
Background: Minute carcinoma is a common finding in prostate core biopsies. Its exact significance remains controversial to the urologists because it does not necessarily imply low Gleason Index or organ confined disease. Methods: Over an 8-year period (1998-2005), 46 radical prostatectomies with a diagnosis of minute carcinoma on previous core biopsies were identified. It represents 12.67% of cases in our material. Minute carcinoma was defined as one focus of cancer 0.5 mm in length or less in the biopsy material. This finding was morphologically characterized in core biopsies and its presence correlated with T category, Gleason index, status of the surgical margins at the apex, high grade PIN, perineurial invasion, and extraprostatic extension on radical prostatectomies. Results: Gleason index £7 (43/46), nuclear enlargement (41/46), infiltrative pattern (41/46), nucleoli (41/46), high grade PIN (27/46), intraglandular secretions (26/46), crystalloids (22/46), were the most consistent findings in core biopsies. Correlations of minute carcinoma with organ confined disease category and with Gleason index were evident. In addition, positive margins, and apex and perineurial invasions were variably found. Conclusions: Minute carcinoma is a common finding in core biopsies and may be associated to some parameters of bad prognosis in radical prostatectomies.
Key Words: Prostate adenocarcinoma, histological criteria, transrectal core biopsy, radical prostatectomy, prognosis.
INTRODUCCIÓN
La utilización sistemática del antígeno prostático específico (PSA) en el screening del cáncer de próstata ha llevado en los últimos años a realizar un gran número de biopsias transrectales de esta glándula como sistema de detección del cáncer rápido, fácil, y fiable. Los valores de PSA, el tacto rectal, y la biopsia transrectal forman los tres pilares en los que se sustenta el despistaje diagnóstico del cáncer de próstata (1). Las biopsias se realizan en muchas ocasiones provocadas por alteraciones bioquímicas, por ejemplo, elevaciones del PSA, alteraciones de la densidad o de la velocidad de PSA, por una palpación anormal sospechosa en el tacto rectal, o por ambas circunstancias.
Habitualmente, las biopsias suelen contener una cantidad de cáncer suficiente que hace posible el diagnóstico sin grandes esfuerzos. Sin embargo, el muestreo de las áreas puncionadas, aunque intencionado, no se libra de imprecisiones que hacen que el tejido con tumor sea en ocasiones mínimo. En estas circunstancias los patólogos se encuentran con casos complicados en los que el cáncer, o sus simuladores, están mínimamente expresados en el material de biopsia, y caminan por la cuerda floja que supone hacer un diagnóstico certero con escaso material y/o con paupérrima representación neoplásica.
Este dilema diagnóstico es tal evidente en la práctica diaria que son varios los autores que han publicado trabajos abordando este tema, preconizándose en los 90 el uso estandarizado de unos criterios mínimos para diagnosticar con fiabilidad el llamado adenocarcinoma diminuto (minute cancer) (2-4). Con posterioridad, otros autores han abundado en el tema y han tratado de delimitar las implicaciones clínicas de este hallazgo histológico (5-14).
En este trabajo se revisan las características histológicas del adenocarcinoma diminuto en la biopsia transrectal por un lado y, por el otro, se analiza la correlación entre estos hallazgos y los observados en las respectivas prostatectomías radicales.
MATERIAL Y MÉTODOS
Durante un periodo de 8 años (1998-2005), se han realizado un total de 363 prostatectomías radicales en el Hospital de Basurto de acuerdo a criterios previamente consensuados en el Comité de Tumores Urológicos (tabla 1) (15). En todos los casos se obtuvieron entre 6 y 8 cilindros-biopsia por punción transrectal para el diagnóstico del cáncer. Los cilindros se remitieron al Servicio de Anatomía Patológica agrupados según el lado de la próstata al que correspondían e inmersos en formol. Siguiendo recomendaciones previas (16), los cilindros del lado derecho y los del lado izquierdo se procesaron de manera independiente en 2 casetes y se obtuvieron una media de entre 24 y 36 cortes histológicos teñidos con hematoxilina-eosina para su estudio. El los casos en que fue necesario se utilizaron técnicas de inmunohistoquímica (CK 5,6, 34bE12, p63, y/o p504S) para asegurar el diagnóstico de cáncer. Los casos que persistieron dudosos fueron etiquetados como «foco de glándulas atípicas pequeñas» y no se han incluido en este estudio.

Siguiendo a otros autores (5), definimos el adenocarcinoma diminuto como «un solo foco de cáncer de menos de 0,5 mm de longitud en la totalidad del material de biopsia transrectal remitido». Además, se ha evaluado histológicamente los hallazgos más característicos de cada caso. Los datos obtenidos se han correlacionado con criterios de importancia diagnóstica y pronóstica en las piezas de prostatectomía radical, como estadio, índice de Gleason, estado de los márgenes quirúrgicos y del ápex, PIN de alto grado, invasión perineural, y extensión extraprostática.
Las piezas quirúrgicas de prostatectomía radical fueron remitidas en fresco al Servicio de Anatomía Patológica y se procesaron siguiendo las recomendaciones del American College of Pathologists (17). La evaluación histológica incluyó, entre otras variables, el estadio según la edición de 2002 de la AJCC (18).
El estudio estadístico (correlación de Spearman, prueba de Wilcoxon) de los datos obtenidos fue realizado con el programa SPSS 10.0 para Windows (Chicago, USA).
RESULTADOS
Siguiendo la definición anteriormente señalada, se ha detectado adenocarcinoma diminuto en 46 casos (12,67%). La edad media de estos pacientes es 65,3 años (rango 53-73), no mostrando diferencias significativas respecto de la serie general de 363 casos. El lado izquierdo se ha visto afectado casi el doble de veces que el derecho (30/16), sin que para ello haya una razón evidente. Los datos histológicos más característicos correspondientes tanto a las biopsias transrectales como a las prostatectomías radicales aparecen reflejados en la Tabla 2. Destaca el hecho de que el índice de Gleason es significativamente más alto en la prostatectomía radical que en la biopsia (p=0,000, test de Wilcoxon) (gráfica 1). En efecto, muchos casos etiquetados en la biopsia con un Indice de Gleason 3+3 se transforman en 3+4 ó 4+3, cuando se analizan las piezas de cirugía radical. En todo caso, existe una correlación significativa de mediana intensidad (Spearman, r=0,480) entre ambos procedimientos respecto de este hallazgo. En el mismo sentido, se detecta una menor presencia de PIN 3 en la biopsia que en la prostatectomía radical (p=0,000, test de Wilcoxon).
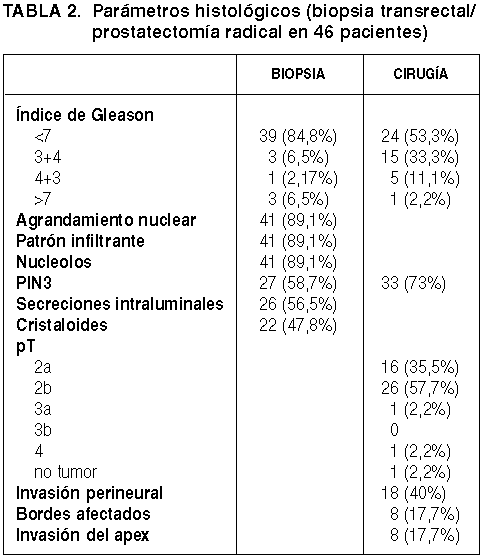
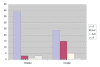
Gráfica 1:
Distribución según índice de Gleason en la biopsia y en la prostatectomía.
Los patrones de crecimiento en el adenocarcinoma diminuto son los ya conocidos en el sistema de gradación de Gleason (fig. 1). A pesar de contener un escaso número de glándulas malignas, la mayor parte de los casos (41/46) presentan un patrón de crecimiento típicamente infiltrante. La presencia de nucleolos (41/46) y el agrandamiento nuclear (41/46) (fig. 2) también son muy frecuentes, aunque no necesariamente coincidentes en cada caso. Otros hallazgos importantes, aunque no tan frecuentes en el material estudiado, son la presencia de PIN de alto grado (27/46), las secreciones intraglandulares basófilas (26/46) y los cristaloides (22/46) (fig. 2). La determinación de PIN de alto grado se realizó aplicando estrictamente los criterios diagnósticos para evitar la confusión con las glándulas normales de la zona central de la próstata.
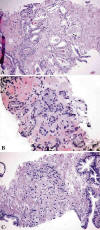
Fig. 1:
Patrones arquitecturales en el adenocarcinoma diminuto de próstata: A)
microglandular (índice de Gleason 3+3), B) de transición entre microglandular y
cordonal por fusión de luces (índice de Gleason 3+4) y C) cordonal con células
sueltas (índice de Gleason 4+5).
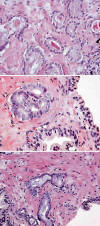
Fig. 2:
Detalles histológicos en el adenocarcinoma diminuto de próstata: A) crecimiento
microglandular infiltrante con cristaloides y luces tapizadas por una hilera de
células, B) crecimiento cribiforme con agrandamiento nuclear y nucleolos
aparentes notorios si se comparan con la glándula benigna adyacente, y C)
microglándulas con secreciones intraluminales basófilas.
La distribución de los casos en función del estadio (pT) aparece reflejada en la gráfica 2. Más del 92% de los casos son cánceres confinados a la glándula, afectando a uno (16/45) o a ambos lados (26/45). Los bordes quirúrgicos están afectados en 8 casos (17,7%). Aunque muy poco frecuente, es reseñable que 1 caso (2,2%) muestre extensión extraprostática focal (pT3a) y que otro (2,2%) invada el cuello vesical (pT4). Existe invasión perineural en el 40% (18/45) y afectación del ápex en el 17,7% (8/45) de las prostatectomías radicales.
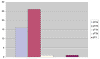
Gráfica 2:
Distribución por estadios (pT).
La búsqueda exhaustiva, analizando todo el material disponible, no ha conseguido detectar el cáncer en 1 caso (tumor evanescente) (19,20). La revisión de su biopsia previa confirma la presencia del mínimo foco de carcinoma.
DISCUSIÓN
Los problemas de muestreo del cáncer en las biopsias pequeñas son un hecho bien conocido y aceptado por los patólogos, y común a todas las topografías y a todos los procedimientos utilizados (punción, biopsia endoscópica…). Por esta razón, los informes de anatomía patológica de este tipo de muestras no incluyen normalmente información concluyente sobre grado histológico, estadificación, u otros parámetros de interés pronóstico, reflejando simplemente la presencia o no de cáncer y, como mucho, la variante histológica.
Sin embargo, y a pesar de tener admitidas todas estas limitaciones, los patólogos tendemos a asumir inconscientemente que poca cantidad de cáncer en una biopsia es sinónimo de tumor pequeño, o de neoplasia de buen pronóstico, y esto no es necesariamente así (21-23). Centrando la problemática en la próstata, hay que señalar que el muestreo en sextantes obteniendo entre 6 a 10 cilindros de tejido prostático es un buen sistema que ha demostrado sobrada eficacia a la hora de definir volumen y estadio tumorales (1,24), aunque existe cierta controversia sobre si un aumento en el número de cilindros obtenidos redundaría en un mayor número de cánceres descubiertos (25-27), y en una mejor asignación del índice de Gleason (28).
Los datos aportados por el patólogo en el material de biopsia transrectal ayudan al urólogo a decidir qué tratamiento aplicar en cada caso, existiendo multitud de trabajos clínicos a este respecto. Cuando la neoplasia está mínimamente expresada en el material de biopsia esta ayuda al urólogo desaparece y la biopsia sólo sirve para confirmar la presencia del tumor. Esta situación es cada vez más frecuente en la práctica diaria (5,29) y ello ha llevado a la publicación de múltiples estudios sobre la manera de optimizar lo más posible el rendimiento diagnóstico de estas muestras con cáncer diminuto (2-4,6,11). En nuestro material, el 12,67% de las prostatectomías radicales en el periodo 1998-2005 están generadas por biopsias con cáncer diminuto, lo cual indica que las cifras de éste deben ser algo mayores puesto que no todos los carcinomas de próstata se tratan mediante cirugía radical y estos no han sido computados para este trabajo. La distribución por años indica una evolución claramente creciente en este periodo. Así por ejemplo, en 1998 sólo hubo 2 biopsias con cáncer diminuto entre las 19 prostatectomías radicales (10,5%) que se realizaron, mientras que en 2005 ha habido 15 entre 72 (20,8%).
En este contexto, el patólogo se enfrenta con un escaso número de glándulas para evaluar como benignas o malignas, y utiliza la inmunohistoquímica como ayuda. Sin embargo, la escasez de tejido tumoral, o supuestamente tumoral, hace que en muchas ocasiones estas técnicas no sean de gran ayuda. En efecto, los cortes necesarios para realizarlas pueden agotar muy pronto la zona sospechosa y no aparecer en una, varias, o todas las inmunotinciones. Además, puede resultar muy comprometido valorar una supuesta negatividad para p504S, p63, o para queratinas (CK5-6, 34bE12) en tan limitado número de glándulas. La positividad para p63 o para queratinas basales puede ser muy focal y discontinua en determinadas situaciones como la atrofia y la hiperplasia post-atrófica, y la ausencia de inmunotinción no significa necesariamente cáncer en un foco muy pequeño. Por lo que respecta a la p504S se han descrito falsos positivos en atrofia y falsos negativos en casos de cáncer bien diferenciado, que es el más problemático, y no se recomienda su evaluación fuera de un contexto favorable (30). En definitiva, que por una u otra razón la inmunohistoquímica no permite tomar una decisión definitiva a favor de cáncer o en contra en bastantes de estos casos. En todo caso, las estrategias de utilización de esta técnica han sido suficientemente analizadas en artículos de revisión recientes (31-33).
Así las cosas, la imagen de hematoxilina-eosina, la experiencia personal, y los criterios histológicos clásicos cobran una especial importancia (9) en la evaluación de estos casos. Estos últimos son los que se han querido resaltar en este trabajo. Los casos con índice de Gleason >7 no plantean grandes problemas diagnósticos a pesar de la escasez de tumor, pero aparecen rara vez (8). En nuestra experiencia sólo el 6,5% (3/46) de los casos de la serie pertenecían a este grupo. Lo más frecuente es encontrar índices bajos, de 3+3 (tabla 2). En estos casos los criterios diagnósticos más fiables son el patrón infiltrante, el agrandamiento nuclear, y la presencia de nucleolos. El primero se detecta con cierta facilidad si las glándulas son pequeñas y tienen contornos angulados y bordes rígidos, pero esto tampoco ocurre siempre. Para evaluar el tamaño del núcleo en cada caso es conveniente comparar los núcleos problema con otros cercanos e inequívocamente benignos. Finalmente, los nucleolos deben ser grandes y eosinófilos para que sean valorables. Con menor frecuencia aparecen secreciones basófilas y/o cristaloides intraluminales que apoyan en caso de sospecha, pero que por si solos carecen del valor suficiente. La experiencia personal es la que conjuga todos los hallazgos, y las ausencias, para emitir un juicio diagnóstico ajustado. La presencia de PIN de alto grado, aunque frecuente en estos casos, no inclina la balanza del diagnóstico hacia ninguno de los lados. Rara vez se producirá la casualidad de tener dentro del foco de cáncer diminuto algún otro de los criterios patognomónicos de malignidad que facilite el diagnóstico, por ejemplo la glomerulación o la invasión perineural genuina. Esta última debe distinguirse de la denominada indentación perineural o pseudoinvasión (34).
Finalmente, si la situación es irresoluble y la inmunohistoquímica no ayuda, lo apropiado es diagnosticar «foco de glándulas pequeñas atípicas» en estos casos. La buena comunicación que debe existir entre ambas especialidades garantizará en estas situaciones el seguimiento estrecho del paciente mediante determinaciones periódicas de PSA sérico y, en su caso, la realización de una nueva biopsia. En este sentido, un estudio reciente indica que este diagnóstico genera una nueva biopsia en 2 de cada 3 casos, y que en el 38% de los pacientes rebiopsiados aparece el cáncer (35). Si no apareciese el cáncer en la segunda biopsia y la clínica y/o las cifras de PSA lo aconsejan, está justificada la realización de biopsias sucesivas a criterio del urólogo y con el consentimiento del paciente.
CONCLUSIÓN
El término carcinoma diminuto, o mínimo, hace referencia exclusivamente a que el tumor aparece mínimamente expresado en la biopsia transrectal, pudiendo corresponder tanto a casos realmente pequeños o precoces, como a casos avanzados que hayan sido muy poco muestreados en el procedimiento aleatorio de obtención de la muestra. Hay que recalcar que dicho término no es necesariamente sinónimo de carcinoma insignificante (36), que hace más referencia a cuestiones clínicas.
La incidencia del denominado carcinoma diminuto de próstata está aumentando en nuestros laboratorios como consecuencia del cada vez más extendido diagnóstico precoz de este tumor en nuestra sociedad. Aunque en general se asocia a índices de Gleason bajos y a estadios precoces, no se pueden descartar a priori casos avanzados o con alta agresividad biológica. Para su correcta identificación, la inmunohistoquímica puede ser una herramienta de no mucha ayuda teniendo en cuenta la escasez del material que interesa analizar. En estos casos el diagnóstico recaerá, una vez más, en las imágenes teñidas con hematoxilina-eosina y la experiencia personal jugará un papel básico.
BIBLIOGRAFÍA
Han M, Partin AW. Nomograms for clinically localized prostate cancer. Part I: radical prostatectomy. Semin Urol Oncol 2002; 20: 123-30.
Epstein JI. Diagnostic criteria of limited adenocarcinoma of the prostate on needle biopsy. Hum Pathol 1995; 26: 223-9.
Bostwick DG, Iczkowski KA. Minimal criteria for the diagnosis of prostate cancer on needle biopsy. Ann Diagn Pathol 1997; 1: 104-29.
Iczkowski KA, Bostwick DG. Criteria for biopsy diagnosis of minimal volume prostatic adenocarcinoma Arch Pathol Lab Med 2000; 124: 98-107.
Allan RW, Sanderson H, Epstein JI. Correlation of minute (0.5 mm or less) focus of prostate adenocarcinoma on needle biopsy with radical prostatectomy specimen: role of prostate specific antigen density. J Urol 2003; 170: 370-2.
D’Amico AV, Wu Y, Chen MH, et al: Pathologic findings and prostate specific antigen outcome after radical prostatectomy for patients diagnosed on the basis of a single microscopic focus of prostate carcinoma with a Gleason score 7. Cancer 2000; 89: 1810-7.
El-Gabry E, Zhou M, Skacel M, Myles J, Levin HS, Reuther AM, Klein E, Magi-Galluzzi C. Low-volume prostate cancer is not necessarily pathologically and clinically insignificant. Mod Pathol 2005; 18 (Suppl 1): 138A.
Fine SW, Epstein JI. Minute foci of Gleason score 8-10 on prostatic needle biopsy. A morphologic analysis. Am J Surg Pathol 2005; 29: 962-8.
Leroy X, Aubert S, Villers A, Ballereau C, Augusto D, Gosselin B. Minimal focus of adenocarcinoma on prostate biopsy: clinicopathological correlations. J Clin Pathol 2003; 56: 230-2.
Ojea Calvo A, Núñez López A, Domínguez Freire F, Alonso Rodrigo A, Rodríguez Iglesias B, Benavente Delgado J, et al. Correlación del estadio anatomopatológico de la pieza de prostatectomía radical con la cantidad de cáncer en la biopsia sextante preoperatoria. Actas Urol Esp 2003; 27: 428-37.
Thorson P, Humphrey PA. Minimal adenocarcinoma in prostate needle biopsy tissue. Am J Clin Pathol 2000; 114: 896-909.
Trpkov K, Tsui J, Mancevska J, Faris P, Yilmaz A. Single core positive and minimal prostate cancer (PCa) on needle biopsy: correlation with tumour volume and clinically insignificant (CI) cancer. Mod Pathol 2005; 18 (Suppl 1): 167A.
Trpkov K, Faris P, Yilmaz A. Radical prostatectomy (RP) after single core positive and minimal prostate cancer (PCa) on ten-core biopsy. Mod Pathol 2005; 18 (Suppl 1): 167A.
Samaratunga H, Yaxley J, Kerr K, McClymont. The significance of finding a small focus of prostatic adenocarcinoma on needle biopsy. Mod Pathol 2006; 19 (Suppl 1): 158A.
López JI, Carrandi J, Loizaga A, Martín-Urreta JC, Unda M. La protocolización de la actividad asistencial: cáncer de próstata. Rev Urol 2004; 5: 117-20.
van der Kwast TH, Lopes C, Santonja C, et al. Guidelines for processing and reporting of prostatic needle biopsies. J Clin Pathol 2003; 56: 336-40.
Henson DE, Hutter RV, Farrow G. Practice protocol for the examination of specimens removed from patients with carcinoma of the prostate gland. Arch Pathol Lab Med 1994; 118: 779-83.
American Joint Committee on Cancer. AJCC Cancer Staging Manual, 6th edition, New York: Springer, 2002: 309-13.
Moskaluk CA. Vanishing prostate cancer syndrome. Symptom of a larger clinical issue. Am J Surg Pathol 2005; 29: 561-3.
Cao D, Hafez M, Berg K, Murphy K, Epstein JI. Little or no residual prostate cancer at radical prostatectomy: Vanishing cancer or switched specimen?: A microsatellite analysis of specimen identity. Am J Surg Pathol 2005; 29: 467-73.
Cupp MR, Bostwick DG, Myers RP, Oesterling JE. The volume of prostate cancer in the biopsy specimen cannot reliably predict the quantity of cancer in the radical prostatectomy specimen on an individual basis. J Urol 1995; 153: 1543-48.
Bruce RG, Rankin WR, Cibull ML, et al: Single focus of adenocarcinoma in the prostate biopsy specimen is not predictive of the pathologic stage of disease. Urology 1996; 48: 75-9.
Noguchi M, Stamey TA, McNeal JE, Yemoto CM. Relationship between systematic biopsies and histological features of 222 radical prostatectomy specimens: Lack of prediction of tumor significance for men with nonpalpable prostate cancer. J Urol 2001; 166: 104-10.
Lopez JI, Etxezarraga C. The combination of millimetres of cancer and Gleason index in core biopsy is a predictor of extraprostatic disease. Histopathology, en prensa.
Chan TY, Chan DY, Lecksell K, Stutzman RE, Epstein JI. Does increased needle biopsy sampling of the prostate detect a higher number of potentially insignificant tumors? J Urol 2001; 166: 2181-4.
Bak JB, Landas SK, Haas GP. Characterization of prostate cancer missed by sextant biopsy. Clin Prostate Cancer 2003; 2: 115-8.
Miyake H, Sakai I, Harada K, Hara I, Eto H. Increased detection of clinically significant prostate cancer by additional sampling from the anterior lateral horns of the peripheral zone in combination with the standard sextant biopsy. Int J Urol 2004; 11: 402-6.
Gao Y, Faris P, Trpkov K. Do increased biopsy sampling and number of positive cores improve the accuracy of final Gleason score (GS) on radical prostatectomy (RP)? Mod Pathol 2005; 18 (Suppl 1): 141A.
Truskinovsky AM, Sanderson H, Epstein JI. Characterization of minute adenocarcinomas of prostate at radical prostatectomy. Urology 2004; 64: 733-7.
Zhou M, Aydin H, Kanane H, Epstein JI. How often does alpha-Methyacyl-CoA Racemase contribute to resolving an atypical diagnosis on prostate needle biopsy beyond that provided by basal cell markers? Am J Surg Pathol 2004; 28: 239-43.
Jiang Z, Wu CL, Woda BA, Dresser K, Xu J, Fanger GR, Yang XJ. P504/a-Methylacyl-CoA Racemase. A useful marker for diagnosis of small foci of prostatic carcinoma on needle biopsy. Am J Surg Pathol 2002; 26: 1169-74.
Hameed O, Sublett J, Humphrey PA. Immunohistochemical stains for p63 and a-Methylacyl-CoA Racemase, versus a cocktail comprising both, in the diagnosis of prostatic adenocarcinoma. A comparison of the immunohistochemical staining of 430 foci in radical prostatectomy and needle biopsy tissues. Am J Surg Pathol 2005; 29: 579-87.
Varma M, Lee MW, Tamboli P, et al. Morphologic criteria for the diagnosis of prostatic adenocarcinoma in needle biopsy specimens. A study of 250 consecutive cases in a routine surgical pathology practice. Arch Pathol Lab Med 2002; 126: 554-61.
Tsuzuki T, Ujihira N, Ando T. Usefulness of epithelial membrane antigen (EMA) to discriminate between perineurial invasion and perineural indentation in prostatic carcinoma. Histopathology 2005; 47: 159-65.
Fadare O, Wang S, Mariappan MR. Practice patterns of clinicians following isolated diagnoses of atypical small acinar proliferation on prostate biopsy specimens. Arch Pathol Lab Med 2004; 128: 557-60.
Klein EA. What is «insignificant» prostate carcinoma? Cancer 2004; 101: 1923-5.