
Vol. 39, n.º 3, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 3, 2006 |
ORIGINALES
Carmen Etxezarraga, José I. López
Servicio de Anatomía Patológica. Hospital de
Basurto. Universidad del País Vasco (EHU/UPV). Bilbao.
ilopez@hbas.osakidetza.net
RESUMEN
Está comúnmente aceptado en la literatura médica que la cantidad de tumor en la biopsia transrectal de próstata se correlaciona con el estadio tumoral y con otros parámetros de importancia pronóstica en el cáncer de próstata. En este trabajo se correlacionan los hallazgos histológicos con impacto pronóstico que se han observado en 363 prostatectomías radicales y en sus respectivas biopsias previas, tratando de evaluar qué sistema de medición del volumen tumoral (milímetros totales de cáncer, número de focos tumorales, y porcentaje de tumor en la biopsia) es el más apropiado en la práctica diaria. Los resultados demuestran que todos ellos se correlacionan con el estadio (pT), con el índice de Gleason, y con la invasión perineural. Además, hemos encontrado que más de 22 milímetros de cáncer en la biopsia predice extensión extraprostática en el 100% de los casos. En conclusión, aunque los 3 métodos pueden ser válidos, pensamos que la determinación de los milímetros totales de cáncer es el sistema de elección para cuantificar el volumen tumoral en las biopsias transrectales debido a su reproductibilidad y fiabilidad.
Palabras Clave: Cáncer de próstata, volumen tumoral, milímetros totales de cáncer, factores pronósticos, biopsia transrectal de próstata.
SUMMARY
It is widely accepted that the amount of tumour in core biopsies correlates with staging and other clinical parameters of prognostic significance in prostate cancer. A series of 363 radical prostatectomies and their respective previous core biopsies have been reviewed trying to correlate 3 different ways of measuring tumour volume (total millimetres of cancer, number of tumour foci, and percentage of tumour in the biopsy) with extraprostatic disease and other ominous parameters in surgical specimens. Results show that all the three systems correlate with pT category, Gleason index, and perineural invasion in radical specimens. In addition, we found that more than 22 millimetres of cancer in the biopsy predicts extraprostatic invasion in 100% of cases. We conclude that, although the three ways of evaluation the tumour volume work, total millimetres of cancer is the system of choice due to its feasibility and reliability.
Key Words: Prostate cancer, tumour volume, total millimetres of cancer, prognostic factors, prostate core biopsy.
INTRODUCCIÓN
El cáncer de próstata es una de las neoplasias con mayor prevalencia en los países desarrollados y constituye un problema sanitario de primer orden (1). La puesta en marcha de programas de depistaje y la mayor concienciación social frente a este problema ha llevado a un aumento muy notable del número de biopsias transrectales, que son, hoy en día, la piedra angular en el diagnóstico de esta enfermedad. Además del diagnóstico de cáncer, se espera del patólogo que ofrezca en su informe información útil para que el urólogo decida cual es el tratamiento óptimo en cada caso.
La prostatectomía radical es modalidad terapéutica de elección en los pacientes con enfermedad confinada a la próstata (2). Para definir con cierta fiabilidad este estadio de manera preoperatoria se han diseñado múltiples algoritmos basados principalmente en el indice de Gleason, en las cifras de PSA sérico, y en el tacto rectal (3). La medición del volumen tumoral en la biopsia transrectal es otro parámetro comúnmente evaluado (4-21) y se ha visto relacionado con la extensión extraprostática (22) y otros signos de mal pronóstico en las piezas quirúrgicas.
En este trabajo se evalúan varias de las maneras de cuantificar preoperatoriamente el volumen tumoral presente en las biopsias transrectales y se revisa la abundante literatura médica al respecto.
MATERIAL Y MÉTODOS
Durante un período de 8 años (1998-2005), se han realizado en el Hospital de Basurto 363 prostatectomías radicales siguiendo los criterios establecidos por el Comité de Tumores Urológicos local (23). Para la estadificación clínica se realizaron tacto rectal, determinación del PSA sérico, y índice de Gleason en la biopsia transrectal. A los pacientes asintomáticos con índice de Gleason >6 en la biopsia y PSA sérico >10 ng/ml se les realizó gammagrafía ósea para detección de enfermedad diseminada. Además, a aquellos que presentaron un PSA >20 ng/ml se les realizó radiografía de tórax y TAC abdomino-pélvico. En casos muy seleccionados en los que se sospechó afectación tumoral extraprostática se practicó resonancia magnética nuclear con bobina endorectal.
De cada paciente se obtuvieron entre 6 y 10 biopsias cilindro que se remitieron al Laboratorio de Patología etiquetadas como pertenecientes al lado derecho o izquierdo. Este material se obtuvo mediante punción directa, no guiada por ecografía, de la zona periférica y de las zonas transicional y central dependiendo de la exploración física y de los exámenes radiológicos previos en cada caso. Siguiendo recomendaciones previas (24), los cilindros de los lados derecho e izquierdo se procesaron independientemente en 2 casetes y se cortaron entre 24 y 36 cortes histológicos de cada bloque.
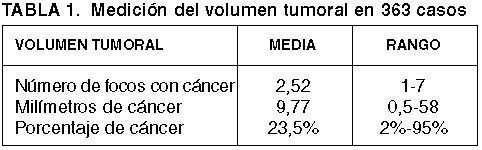
La cuantificación del volumen tumoral se realizó de 3 formas: suma total de milímetros de tumor, número de focos tumorales, y porcentaje de tumor en el material estudiado sumando lo observado en ambos lados, derecho e izquierdo. En el caso de que se identificasen 2 focos tumorales en el mismo cilindro, se consideró como un solo foco midiendo desde los extremos de ambos.
Las prostatectomías radicales se remitieron en fresco y se procesaron siguiendo las recomendaciones del American College of Pathologists (25). La evaluación histológica de las piezas incluyó, entre otras variables, la estadificación de acuerdo a la edición 2002 de la AJCC (26).
Los datos obtenidos fueron analizados estadísticamente (SPSS 10.0 para Windows, Chicago, USA).
RESULTADOS
Desde Enero de 1998 hasta Diciembre de 2005, 4774 pacientes han sido biopsiados por via transrectal en nuestro Hospital. En 1420 (29,7%) de ellos se diagnosticó cáncer y en 363 se practicó cirugía radical. La edad media de los pacientes fue 65 años (rango 43-77). Dieciocho (4,95%) pacientes presentaron 2 o más biopsias negativas previas, pero la prostatectomía se terminó realizando en función de criterios clínicos estrictos que incluían densidad y velocidad de PSA, tactos rectales repetidos, estudios de imagen, y focos de glándulas pequeñas atípicas en las biopsias transrectales. En todos ellos se demostró la existencia de cáncer en las prostatectomías radicales. Por otro lado, en 5 (1,37%) pacientes no se logró demostrar el cáncer en la prostatectomía radical (tumor evanescente) (27).
Las diferentes maneras de cuantificar el volumen tumoral mostraron en todos los casos una correlación estadísticamente significativa y de alta intensidad (rho de Spearman): milímetros de tumor/número de focos (r=0,820), milímetros de tumor/porcentaje de tumor (r=0,810), y número de focos/porcentaje de tumor (r=0,771).
En la propia biopsia transrectal, los milímetros de tumor se correlacionan (rho de Spearman) con la afectación bilateral por el cáncer (r=0,515), con el índice de Gleason (r=0,466), con la invasión perineural (r=0,447), y con el PIN de alto grado (r=0,213). Por su parte, el número de focos tumorales lo hace con los mismos parámetros y con intensidades similares (afectación bilateral, r=0,731; índice de Gleason, r=0,306; invasión perineural, r=0,391; PIN 3, r=0,219).
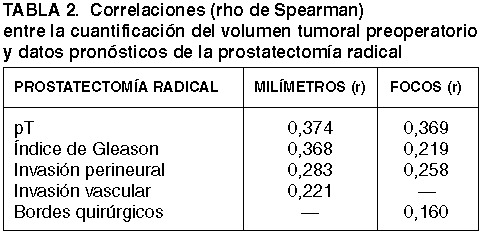
De la misma manera, dichos parámetros se correlacionan también de manera significativa con datos de gran interés pronóstico en las piezas de prostatectomía radical, como por ejemplo el pT, el índice de Gleason, la invasión perineural, la invasión vascular, o la afectación de los bordes quirúrgicos. Los valores estadísticos de cada uno de estos datos aparecen reflejados en la tabla 2.
Por último, la regla de decisión del modelo de regresión logística indica que por encima de 22 mm de tumor en la biopsia transrectal todos los cánceres presentan extensión extraprostática en la cirugía radical [coeficiente para la variable mm 0,083 (p=0,000), constante de –1,835 (p=0,000)].
DISCUSIÓN
El despistaje del cáncer de próstata incluye la biopsia transrectal en aquellos pacientes que presentan elevación sérica del PSA y/o tacto rectal sospechoso. El porcentaje de cáncer descubierto en este material varía ampliamente en la bibliografía consultada, pero en nuestro material ronda el 30%. El diagnostico histológico de cáncer en tan escaso tejido no está exento de problemas (28,29) y este hecho ha llevado a la publicación de algunas recomendaciones para el manejo óptimo de este material (30).
La demostración de extensión extraprostática y de otros parámetros histológicos en las piezas quirúrgicas es un factor de mal pronóstico y su inclusión en el informe anatomo-patológico una enorme ayuda para la toma de decisiones por parte del urólogo. Definir si el tumor está confinado a la próstata o no es una información primordial. En nuestra casuística, el 20% de los casos finalmente operados presentaron extensión tumoral fuera de los confines del órgano, lo cual es un volumen importante, y haberlo previsto hubiera sido muy importante en términos clínicos.
Entre otros factores, la cuantificación del volumen tumoral es uno de los parámetros mejor estudiados y que ha sido enfocado de múltiples maneras (4-21) (tabla 3). En este trabajo se ha evaluado este parámetro mediante la cuantificación del número de focos tumorales, la medición de los milímetros de tumor totales, y la evaluación del porcentaje de tumor respecto del total del tejido remitido. Todos ellos han demostrado ser igualmente útiles. Sin embargo, a la hora de elegir uno de ellos como método de rutina en la práctica diaria parece que la medición de los milímetros de tumor totales en la biopsia es el más cómodo. Se trata simplemente de marcar los extremos de cada foco con un marcador indeleble y sumar. Sin embargo, evaluar el número de focos tiene el problema de que la fragmentación del material en el procesamiento, posible en un material tan frágil, altera sin duda el resultado final, y definir el porcentaje de tejido infiltrado por tumor respecto de total de tejido obliga a realizar más mediciones y un cálculo. En nuestra experiencia, más de 22 mm de tumor en la biopsia se asocia con extensión extraprostática en el 100% de los casos, y la cantidad de tumor expresada en milímetros está directamente relacionada con otros parámetros de interés pronóstico.

Este trabajo no pretende relegar la elevación de PSA sérico, el tacto rectal anormal, y otros parámetros clínicos de gran interés a un segundo plano. De hecho, la selección de los candidatos a biopsia se hace fundamentalmente atendiendo a ellos. Se intenta, por un lado, enfatizar la importancia del patólogo en la toma de decisiones clínicas y, por otro, demostrar que con un simple microscopio cualquier patólogo de cualquier hospital puede, en poco tiempo, proporcionar al urólogo información decisiva simplemente midiendo los milímetros totales de tumor en la biopsia transrectal de próstata.
BIBLIOGRAFÍA
Jemal A, Murray T, Ward E, et al. Cancer statistics, 2005. CA Cancer J Clin 2005; 55: 10-30.
Trojan L, Kiknavelidze K, Knoll T, et al. Prostate cancer therapy: standard management, new options and experimental approaches. Anticancer Res 2005; 25: 551-61.
Partin AW, Kattan MW, Subong EN, et al. Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer. A multi-institutional update. JAMA 1997; 277: 1445-51.
Narayan P, Gajendran V, Taylor SP, et al. The role of transrectal ultrasound-guided biopsy-based staging, preoperative serum prostate-specific antigen, and biopsy Gleason score in prediction of final pathologic diagnosis in prostate cancer. Urology 1995; 46: 205-12.
Wills ML, Sauvageot J, Partin AW, et al. Ability of sextant biopsies to predict radical prostatectomy stage. Urology 1998; 51: 759-64.
Taneja SS, Penson DF, Epelbaum A, et al. Does site specific labelling of sextant biopsy cores predict the site of extracapsular extension in radical prostatectomy surgical specimen? J Urol 1999; 162: 1357-8.
Bostwick DG, Qian J, Bergstralh E, et al. Prediction of capsular perforation and seminal vesicle invasion in prostate cancer. J Urol 1996; 155: 1361-7.
Egan AJ, Bostwick DG. Predicition of extraprostatic extension of prostate cancer based on needle biopsy findings: perineural invasion lacks significance on multivariate analysis. Am J Surg Pathol 1997; 21: 1496-500.
Ravery V, Chastang C, Toublanc M, et al. Percentage of cancer on biopsy cores accurately predicts extracapsular extension and biochemical relapse after radical prostatectomy for T1-T2 prostate cancer. Eur Urol 2000; 37: 449-55.
Sebo TJ, Bock BJ, Cheville JC, et al. The percent of cores positive for cancer in prostate needle biopsy specimens is strongly predictive of tumor stage and volume at radical prostatectomy. J Urol 2000; 163: 174-8.
Grossklaus DJ, Coffey CS, Shappell SB, et al. Prediction of tumour volume and pathological stage in radical prostatectomy specimens is not improved by taking more prostate needle-biopsy cores. BJU Int 2001; 88: 722-6.
Noguchi M, Stamey TA, McNeal JE, et al. Relationship between systematic biopsies and histological features of 222 radical prostatectomy specimens: lack of prediction of tumor significance for men with nonpalpable prostate cancer. J Urol 2001; 166: 104-9.
Sebo TJ, Cheville JC, Riehle DL, et al al. Predicting prostate carcinoma volume and stage at radical prostatectomy by assessing needle biopsy specimens for percent surface area and cores positive for carcinoma, perineural invasion, Gleason score, DNA ploidy and proliferation, and preoperative serum prostate specific antigen: a report of 454 cases. Cancer 2001; 91: 2196-204.
Grossklaus DJ, Coffey CS, Shappell SB, et al. Percent of cancer in the biopsy set predicts pathological findings after prostatectomy. J Urol 2002; 167: 2032-5.
Bismar TA, Lewis JS Jr, Vollmer RT, et al. Multiple measures of carcinoma extent versus perineural invasion in prostate needle biopsy tissue in prediction of pathologic stage in a screening population. Am J Surg Pathol 2003; 27: 432-440.
Gancarczyk KJ, Wu H, McLeod DG, et al. Using the percentage of biopsy cores positive for cancer, pre-treatment PSA, and highest biopsy Gleason sum to predict pathologic stage after radical prostatectomy: the Center for Prostate Disease Research nomograms. Urology 2003; 61: 589-95.
Horiguchi A, Nakashima J, Horiguchi Y, et al. Prediction of extraprostatic cancer by prostate specific antigen density, endorectal MRI, and biopsy Gleason score in clinically localized prostate cancer. Prostate 2003; 56: 23-9.
Ojea Calvo A, Nuñez Lopez A, Dominguez Freire F, et al. Correlation of the anatomo-pathological staging of radical prostatectomy specimens with the amount of cancer in the preoperative sextant biopsy. Actas Urol Esp 2003; 27: 428-37.
Naya Y, Slaton JW, Troncoso P, et al. Tumor length and location of cancer on biopsy predict for side specific extraprostatic cancer extension. J Urol 2004; 171: 1093-7.
Gao X, Mohideen N, Flanigan RC, et al. The extent of biopsy involvement as an independent predictor of extraprostatic extension and surgical margin status in low risk prostate cancer: implications for treatment selection. J Urol 2000; 164: 1982-6.
Winkler MH, Khan FA, Kulinskaya E, et al. The total percentage of biopsy cores with cancer improves the prediction of pathological stage after radical prostatectomy. BJU Int 2004; 94: 812-5.
Lopez JI, Etxezarraga C. The combination of millimetres of cancer and Gleason index is a predictor of extraprostatic disease. Histopathology, 2006; 48: 663-7.
López JI, Abad T, Carrandi J, et al. La protocolización de la actividad asistencial: cáncer de próstata. Revista de Urología 2004; 5: 117-20.
van der Kwast TH, Lopes C, Santonja C, et al. Guidelines for processing and reporting of prostatic needle biopsies. J Clin Pathol 2003; 56: 336-340.
Henson DE, Hutter RV, Farrow G. Practice protocol for the examination of specimens removed from patients with carcinoma of the prostate gland. Arch Pathol Lab Med 1994; 118: 779-83.
American Joint Committee on Cancer. AJCC Cancer Staging Manual, 6th edition, New York: Springer, 2002: 309-13.
Moskaluk CA. Vanishing prostate cancer syndrome. Symptom of a larger clinical issue. Am J Surg Pathol 2005; 29: 561-3.
Etxezarraga C, Bilbao FJ, López JI. Revisión de los adenocarcinomas de próstata con patrón pseudohiperplásico y pseudoatrófico. Rev Esp Patol, en prensa.
Etxezarraga C, López JI. El adenocarcinoma diminuto en la biopsia transrectal de la próstata. Correlación con los hallazgos en la prostatectomía radical en 46 casos. Rev Esp Patol, en prensa.
Epstein JI The diagnosis and reporting of adenocarcinoma of the prostate in core needle biopsy specimens. Cancer 1996; 78: 350-6.