
Vol. 39, n.º 2, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 2, 2006 |
CASUÍSTICA
Carlos Ortiz-Hidalgo1, Armando Carvajal-Dosamantes2
1 Departamento de
Patología. Centro Médico ABC, México DF. Departamento de Biología Celular y
Tisular, Universidad Panamericana, México DF.
2 Departamento de
Patología. Hospital CIMA Hermosillo, Sonora, México.
cortiz@abchospital.com
RESUMEN
Antecedentes: El perineuroma maligno (PM) o tumor maligno de vaina nerviosa (MPNST) con diferenciación perineural, es poco frecuente. Presentamos un caso de PN, con evidencia inmunohistoquímica. Métodos: Paciente femenina de 58 años de edad con tumor retroperitoneal, sin datos clínicos de neurofibromatosis. Resultados: El tumor presentaba áreas extensas de necrosis y estaba formado por células atípicas fusiformes «empaquetadas» formando fascículos entrecruzados con patrón estoriforme y formando estructuras verticiladas. Otras áreas presentaban estroma laxo mixoide donde células alargadas formaban estructuras celulares paralelas. Las células tumores mostraron inmunoreactividad para EMA, Glut-1 y Claudina-1. Hubo una población de células CD34 positivas, que coexpresaron EMA, que estaban principalmente distribuidas en las zonas mixoides. Ninguna de las células neoplásicas fue positiva a la proteína S-100. Conclusiones: Menos del 5% de los MPNST, presentan diferenciación perineural, a los que se les ha designado perineuromas malignos. La demostración inmunohistoquímica de diferenciación perineural es por medio de la expresión de EMA, Glut-1 y Claudina-1. El seguimiento limitado que se tiene de estos pacientes, sugiere que los perineuromas malignos podrían tener mejor pronóstico que los MPNST convencionales.
Palabras Clave: Perineuroma maligno, tumor maligno de vaina nerviosa periférica, perineurio.
SUMMARY
Introduction: Malignant perineurioma (MP) or malignant peripheral nerve sheath tumor (MPNST) with perineurial differentiation is an unusual tumor. We report a case of MP with immunohistochemical evidence. Material and Methods: A 58 year-old female with a retroperitoneal tumor with no clinical evidence of neurofibromatosis. Results: The tumor presented extensive areas of necrosis and was composed of tightly packed atypical spindle shaped cells arranged in intersecting fascicles in a storiform pattern and forming whorled structures. Other areas showed a loose myxoid stroma, were long spindle-shaped tumor cells formed long cords arranged in parallel. Tumor cells showed immunoreactivity for EMA, Glut-1 and Claudin-1. A small number of CD34 positive cells, coexpressing EMA, were present mainly distributed in the loose myxoid areas. None of the tumor cells were reactive with S-100 protein. Conclusion: Only a small proportion, probably less than 5% of MPNST have been shown to demonstrate perineurial cell differentiation, and they have been called malignant perineuriomas. EMA, Glut-1 a, Claudin-1 are used as immunohistochemical evidence of perineurial cell differentiation. The limited follow-up data available suggest that the malignant peirneuriomas may have a better prognosis than the conventional MPNST
Key words: Malignant perineurioma, malignant peripheral nerve sheath tumor, perineurium.
INTRODUCCIÓN
Los tumores de la vaina nerviosa periférica, están compuestos por uno a varios de los componentes celulares normales del nervio periférico; los schwannomas y los neurofibromas representan los ejemplos más comunes (1). Los Schwannomas están constituidos exclusivamente por células de Schwann, mientras que en los neurofibromas participan no solo las células de Schwann sino también, en proporción variada, fibroblastos, axones y células perineurales.
Los tumores originados del perineurio son poco frecuentes, generalmente benignos y se presentan en dos formas (2-4). Una es la variante intraneural, que incluye lo que antes era designado como «neuropatía hipertrófica localizada», que histológicamente está caracterizada por proliferación de células perineurales en estructuras formando «bulbos o telas de cebolla», y la otra es el perineuroma de tejidos blandos o perineuroma extranerual, que puede presentarse como variante celular, esclerosada, reticular, plexiforme y lipomatosa (3,5,6).
Los tumores malignos de vaina nerviosa periférica (MPNST, por sus siglas en ingles —Malignant Peripheral Nerve Sheath Tumor—) muestran, al igual que su contraparte benigna, una marcada variabilidad celular (7). La mayor parte de los MPNST derivan de células de Schwann, pero otros componentes celulares, que incluyen fibroblastos y células perineurales, pueden contribuir, en diferente proporción a la formación de estos tumores (7). En 1989, Hirose y col. describieron por primera vez un tumor maligno de vaina nerviosa periférica, compuesto exclusivamente por células perineurales (8). Histológicamente el tumor estaba compuesto por células fusiformes formando estructuras celulares verticiladas o arremolinadas (celular whorls) y agregados celulares estoriformes, semejantes a lo encontrado a los perineuromas benignos (8). Son pocos los casos de perineuroma maligno que han sido informados en la literatura (9-12). Informamos en este estudio un caso de perineuroma maligno (tumor de vaina nerviosa periférica, perineural) retroperitoneal, que mostró inmuoreactividad a los marcadores de diferenciación perinerual EMA y Glut-1 y Claudina-1, haciendo énfasis en el diagnóstico diferencial histológico e inmunohistoquímico de esta neoplasia poco frecuente.
MATERIAL, MÉTODOS Y RESULTADOS
Mujer de 58 años con tumor retroperitoneal que involucraba parcialmente pared posterior de útero y recto. La paciente no tenía datos clínicos de neurofibromatosis. El tumor retroperitoneal, midió 15 cm de diámetro mayor y era de superficie externa firma lobulado amarillo blanquecino. Al corte presentaba áreas sólidas firmes alternando con zonas de necrosis. Histológicamente las áreas conservadas del tumor estaban compuestas por células fusiformes con dos patrones morfológicos. Uno estaba formado de grupos celulares fusiformes con citoplasma eosinófilo con áreas compactas con patrón estoriforme y en forma multifocal las células se agregaban dando forma de estructuras verticiladas en espirales celulares dando la apariencia de «telas de cebolla» (fig. 1). En estas zonas compactas además había células de aspecto epitelioide, con abundante citoplasma eosinófilo formando estructuras semejantes a las encontradas en el perineuroma intraneural (fig. 2|). Las células presentaban núcleos con pleomorfismo leve y numerosas mitosis (9 mitosis en 10 campos de 40x). El otro patrón estaba formado igualmente por células fusiformes con citoplasma escaso, filiforme eosinófilo, inmersas en matriz laxa, azul alciano positiva. En estas áreas la atipia nuclear era más prominente (fig. 3).
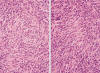
Fig. 1:
Perineuroma maligno. Las figuras muestran células fusiformes con citoplasma
eosinófilo y patrón verticilado.
![]()
Fig. 2:
Perineuroma maligno. Área celular. Las células perineurales malignas, forman
agregados celulares concéntricos similar a lo observado en el perineuroma
intraneural.
![]()
Fig. 3:
Perineuroma maligno. A y B: Áreas laxas/mixoides con células fusiformes y atipia
celular. C. Inmunhistoquímica en las áreas mixoides con anti-claudina-1.
Por inmunohistoquímica las células neoplásicas, tanto en las áreas compactas como en las laxas mixoides, mostraron positividad difusa e intensa al EMA (Dako 1:150), GLUT-1 (Neo Markers 1:100) y Claudin-1 (Spring Bioscience, prediuido), y débil multifocal al CD34 (Cell Marque 1:100) (fig. 4) y al CD68 (Kp-1/Cell Marque 1:800) y estaban rodeadas focalmente por colágena IV (Dako 1:100) Por medio de doble inmunomarcación pudimos demostrar que las células neoplásicas EMA positivas, coexpresaban hasta en aproximadamente 50% el CD34 (fig. 4 d). El índice de maduración medido con Ki-67 fue de 40%. Las células neoplásicas fueron uniformemente negativas a la proteína S-100 (Biogenex), a la queratina AE1-3 (Cell Marque 1:100), al CD21 (Dako 1:50) y CD35 (Dako 1:20) y CD117 (Dako 1:600).
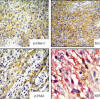
Fig. 4:
Perineuroma maligno. Inmunohistoquímica. A) áreas compactas, inmunomarcación
para Glut-1. B) Patrón verticilado. Inmunoreactividad para Claudina -1. C) Áreas
laxas/mixoides. Inmunomarcación para EMA, mostrando las células perineurlaes
malignas delgadas elongadas. D) Doble inmunomarcaje EMA/CD34 (EMA
Diaminobencidina/CD34 nueva fuscina) mostrando inmunorreactividad de ambos
marcajes en las células fusiformes.
DISCUSIÓN
El perineurio, conocido también como capa de Henle o vaina laminar de Ranvier, es la cubierta que envuelve de forma individual cada uno de los fascículos nerviosos, y está compuesto por 8 a 15 láminas de células perineurales, continuas y concéntricas a cada fascículo, unidas entre ellas por «zónulas ocludens y hemidesmosomas». (1,13,14). El perineurio es la continuación de la pia-aracnoides, por lo que no es sorprendente la similitud morfológica, ultraestructural e inmunohistoquímica (1). De hecho los perineuromas han sido considerados por algunos investigadores como la contraparte periférica de los meningiomas (15).
Por inmuohistoquímica las células perineurales expresan EMA, Glut-1 y claudina-1 y son negativas a la proteína S-100, lo que las distingue de las células de Schwann (1). Por microscopía electrónica, las células perineurales, son aplanadas, con procesos citoplásmicos bipolares delgados con espesor promedio de 1 a 1,5 µm. Presentan escasos organelos, uniones estrechas de tipo zónula ocludens y hemidesmosomas y poseen múltiples vesículas pinocíticas distribuidas predominantemente por debajo de la membrana celular (13). Las células perineurales presentan membrana basal discontinua. Estas mismas características ultraestructurales, se encuentran presentes en los tumores de células perineurales (16,17).
Las células perineurales participan en la formación de diversas lesiones comunes del nervio periférico que incluyen el neuroma traumático, el neuroma de mucosas, el neuroma de Morton, el neuroma paciniano, el tumor mixoide de vaina nerviosa periférica y el neurofibroma (1,2,7,18). Existen proliferaciones neoplásicas compuestas exclusivamente de células perineurales, conocidas como perineuromas, que incluyen 1) el perineuroma de tejidos blandos (fibroma perineural estoriforme) y las variantes esclerosada, reticular, plexiforme y lipomatosa y 2) el perineuroma intraneural (2,3,6). El primero fue descrito en la revista Cáncer en 1978 por Sydney Lazarus y Louis Trombetta, y corresponde a proliferación benigna bien circunscrita de células perineurales, que se agregan formando estructuras verticiladas o patrón estoriforme, alternando con áreas mixoides (19). Giannini y col. han demostrado, utilizando hibridación in-situ con fluorescencia (FISH), deleción de todo o parte del cromosoma 22 en perineuromas de tejido blandos lo que indica el carácter neoplásico de esta lesión (20). La proliferación de células perineurales acompañada de fibrosis extensa, es lo que caracteriza a la variante esclerosada (Perineuroma esclerosado), que se presenta con predilección en los dedos de la mano y palmas en adultos jóvenes (5). En esta variante, Brock y col. han demostrado alteración del cromosoma 10 (10q) (15).
La variante intraneural del perineuroma, produce crecimiento fusiforme segmentario, del endoneurio (intraneural) y está histológicamente compuesta por pequeños agregados de células perineurales alrededor de axones y células de Schwann, dando la apariencia de «telas de cebolla» (onion bulb) (2). Esta lesión fue originalmente considerada una forma localizada de la neuropatía hipertófica (enfermedad de Dejerine-Sotas y enfermedad de Charcot-Marie-Tooth). Sin embargo, fue Emory y col. quienes en 1995, confirmaron su naturaleza neoplásica demostrando anormalidades del cromosoma 22 en análisis citogenético y por hibridación in-situ con fluorescencia (FISH), y llamaron a esta lesión «perineuroma intraneural» (21).
Las células perineurales contribuyen en grado variable a la formación celular del tumor maligno de vaina nerviosa periférica (MPNST) (22). Fueron Hirose y col. en 1989, quienes por primera vez informaron un caso de MPNST compuesto exclusivamente por células perineurales, en un paciente de 52 años de edad con un tumor localizado en tejidos blandos de la espalda, de 6,5 cm diámetro mayor (8). El tumor estaba compuesto por células fusiformes mostrando tanto patrón verticilado como estoriforme, y reaccionaron por inmuohistoquímica, únicamente al EMA y resultaron negativos a la proteína S-100 y al CD57 (Leu7) (2,8). Subsecuentemente varios estudios han demostrado la participación de células perineurales en el MPNST (9,17,22).
Los MPNST compuestos exclusivamente por células perineurales, presentan histológicamente células fusiformes ordenadas en patrón verticilado, estoriforme y forman agregados celulares pequeños arremolinados dando aspecto de «tela de cebolla» (figs. 1 y 2). Pueden también presentar áreas laxas con células fusiformes inmersas en matiz mixoide positivas para mucopolisacáridos ácidos (8,22) (fig. 3). Por inmunomarcación en cualquiera de los patrones mencionados, hay expresión de EMA, GLUT-1 y claudin-1, que en este contexto son considerados marcadores de diferenciación perineural, y estas mismas células son negativas para la proteína S-100 (1,23) (fig. 4).
El antígeno epitelial de membrana (EMA), también llamada episialina, pertenece a una familia heterogénea de proteínas transmembrana altamente glucosiladas, conocidas como glóbulos de la grasa de la lecha human (Human milk fat globules), presentes en diversas líneas celulares. En el nervio periférico, el EMA distingue el perineurio de las de Schwann (24). El perineurio además puede ser identificado por medio de la inmunomarcación con GLUT-1 (22). La mayoría de las células de los mamíferos transportan glucosa a través de una familia de proteínas transmembrana conocidas como «transportadores de glucosa» (GLUT). Por medio de clonación molecular de estos transportadores, se ha identificado a una familia de genes relacionados que codifican por lo menos a 13 proteínas de peso molecular aproximado entre 40 y 60kDa, conocidas como Glut-1 al Glut-13 (22). Por inmunohistoquímica, el Glut-1 ha sido identificado en diversas células normales y neoplásicas así como en la membrana del eritrocito. En el nervio periférico el Glut-1 se expresa selectivamente en el perineurio y en las células perineurales de tumores de vaina de nervio periférico benignos y malignos (22). La expresión difusa del Glut-1 en nuestro caso fue similar a la observada con el EMA, tanto en intensidad como en localización (fig. 4).
Recientemente se identificó a la claudina-1 como marcador de células perineurales (24). Las claudinas (del latín «claudere» cerrar) son un grupo de aproximadamente 20 proteínas integrales de membrana, descritas en 1998 por Furose y col. que participan en las uniones celulares (25). En el sistema nerviosos periférico, la expresión de claudina-1 se encuentra limitada a la vaina perineural y está presente en los perineuromas (23). En nuestro caso, la claudina-1 mostró inmunoreactividad similar a la observada con el EMA y del Glut-1, lo que confirma la diferenciación perineural en esta neoplasia (23). El CD34 se expresó en forma difusa multifocal en células fusiforme, tanto en las áreas celulares como en las zonas laxas/mixoides. Interesantemente por medio de doble inmunomarcación pudimos evidenciar que las células EMA positivas, coexpresaban CD34 hasta en aproximadamente 50%. Estas células podrían ser las llamadas «células intermedias» descritas por Erlandson y Hirose (17,22,26). Estudios ultraestructuraes en neurofibromas han demostrado la presencia de «células intermedias» con características tanto de células perineurales como de fibroblasto (17,26). Nuestros resultados inmunohistoquímicos indican la presencia de estas células intermedias (EMA+ /CD34+), localizadas predominantemente en las zonas laxas/mixoides.
Aunque se ha sugerido que el pronóstico de MPNST con diferenciación perineural, es más favorable que el de los MPNST convencionales (22), son pocos los casos hasta hoy estudiado y se requieren de mas estudios comparativos, para poder dictar conclusiones sobre el pronóstico del perineuroma maligno (22). A diferencia del MPNST convencional, los perineuromas malignos o MPNST con diferenciación perinerual, no han sido asociados a neurofibromatosis tipo I, o a neurofibroma preexistente (22).
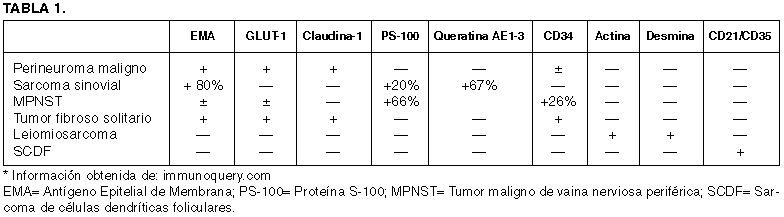
El perineuroma maligno o MPNST perineural, puede histológicamente ser confundido con otras neoplasias de tejidos blando (tabla 1). Cuando el perineuroma maligno se presenta en tejidos blandos superficiales, el diagnóstico con dermatofibrosarcoma protúberans (DFP), puede ser difícil. De hecho, por su configuración histológica estoriforme y los escasos casos informados con expresión de EMA, el DFP ha sido considerado de posible origen perineural (27,28). Sin embargo, son solo pocos los casos informados de DFSP positivos al EMA y por utraestructura, las células del DFSC no presentan lámina basal y vesículas pinociticas como se encuentran en las células perineurales (17). El sarcoma sinovial (SS) monofásico puede confundirse histológicamente con perineuroma maligno. EL SS es generalmente positivo a diversas queratinas y Bcl-2, y comparte con el perineuroma la positividad al EMA. El SS puede presentar inmunoractividad predominantemente citoplásmica con el CD99, calretinina y CD56 marcadores que son negativos en el perineuroma maligno (29). Además hasta en un 90% de los casos de SS, se puede identificar la translocación recíproca t (X:18) (p11.2;q11.2) que resulta en la fusión del gen SYT («synovial sarcoma tumor») localizado en el cromosoma 18, con cualquiera de los genes del cromosoma X SSX1 o SSX2 («synovial sarcoma X»). El tumor fibrosos solitario, aunque histológicamente comparte características con el perineuroma maligno, es negativo al EMA y fuertemente positivo al CD34 (30). Los leiomiosarcomas presentan inmuorreactividad a los marcadores musculares como la actina, la desmina y la caldesmona, y no presentan patrón estoriforme o verticilado. A pesar de que el patrón estoriforme puede estar presente en el histiocitoma fibroso maligno, su característico pleomorfísmo, su composición celular fibroblástica y miofibroblástica, y la ausencia de marcadores perineurales, es de ayuda para su diferenciación (31). El diagnóstico diferencial con el sarcoma de células dendríticas foliculares (células de Nossal), descrito en 1986 por Monda, Warnke y Rosai, constituye un punto importante, por que ambos comparten el patrón histológico verticilado y estoriforme (31,32). Sin embargo la diferencia estiba en la expresión de CD21 y CD35, marcadores característicos de células dendríticas foliculares.
Recientemente Smith y col. han sugerido que el sarcoma epitelioide, por la expresión de EMA, GLUT-1 y claudina-1, podría ser una forma de perineuroma maligno (33).
En resumen presentamos en este informe un caso en donde son las células perineurales las que están proliferando, en un tumor maligno de vaina nerviosa periférica (perineuroma maligno). Los perineuromas malignos son característicamente S-100 negativo y pueden expresar los marcadores de diferenciación perineural EMA, Glut-1 y Claudina-1, y presentan patón histológico verticilado y/o estoriforme y/o laxo, sugerente de diferenciación perineural. Es importante hacer la diferencia entre el tumor maligno de vaina nerviosa convencional (S-100+ /EMA- /Glut-1-) y el perineuroma maligno (S-100-/ EMA+ /Glut-1+), porque, además de estar identificando la células neoplásica proliferante, al parecer, la diferenciación perineural le confiere mejor pronóstico, dentro del grupo de tumores malignos de vaina nerviosa periférica (22).
AGRADECIMIENTOS
Agradecemos al Dr. Alfonso Heras de Bio SB, California, USA, por la cortesía del anticuerpo anti-clauina-1. Además extendemos los agradecimientos al HT José E Torres de al sección de inmuohistoquímica del Hospital ABC, por haber realizado los estudios de inmunomarcación.
BIBLIOGRAFÍA
Ortiz Hidalgo C, Weller RO. Peripheral Nervous System. En: Miles ST, editor. Histology for pathologists. Baltimore: Lippincot Williams & Wilkins 2006 (en prensa).
Tsang W. Perineuriomas: Perineurial cell neoplasms with distinct extra end intra-neural forms. Adv Anat Pathol 1996; 3: 212-22.
Rankine AJ, Filion PR, Platten MA, Spangnolo DV. Perineurioma: a clinicopathological study of eight cases. Pathology 2004; 36: 309-15.
Hornick JL. Fletcher CDM. Soft tissue perineurioma. Clinicopathologic analyisis of 81 cases including those with atypical features. Am J Surg Pathol 2005; 29: 845-58.
Canales Ibarra C, Magariños G, Olsoff-Pagovich P Ortiz-Hidalgo C. Cutaneous sclerosing perineurioma of the digits: an uncommon soft tissue neoplasm. Report of two cases with immunohistochemical analysis. J Cut Pathol 2003; 30: 577-81.
Mentzel T, Kutzner H. Reticular and plexiform perineurioma: clinicopathological and immunohistochemical analysis of two cases and review of perineurial neoplasms of skin and soft tissues. Virchow Arch 2005; 447: 677-82.
Sheithauer BW, Woodruff JM, Erlandosn RA. Primary malignant nerve sheath tumor. En : Tumor of Peripheral Nervous System. Atlas of tumor pathology. Washington, D.C: AFIP. 1997; 293-358.
Hirose T, Sumitomo M, Kudo E, Hasegawa T, Teramede T, Murase M, Higase Y, Ikata T, Hizawa K. Malignant peripheral nerve sheath tumor (MPNST) showing perineurial cell differentiation. Am J Surg Pathol 1989; 13: 613-20.
Zamecnik M, Michal M. Malignant peripheral nerve sheath tumor with perineurial differentiation (Malignant perineurioma). Pathol Intern 1999; 49: 69-73.
Fukunaga M. Malignant perineurioma of soft tissue. Virchows Arch 2001; 439: 212-4.
Rosenberg AS, Langee CL, Stevens GL, Morgan MB. Malignant peripheral nerve sheath tumor with perineurial differentiation: «malignant perineurioma»: J Cutan Pathol 2002; 29: 362-7.
Karaki S, Mochida J, Lee YH, Nishimura K, Tsutsumi Y. Low-grade malignant perineurioma of the paravertebral column, transforming into a high-grade malignancy. Pathol Int 1999; 49: 820-5.
Reina MA, López A, Villanueva MC, Andrés JA León GI. Morfología de los nervios periféricos, de sus cubiertas y de su vascularización. Rev Esp Anestesiol Reanim 2000; 47: 466-75.
Reina MA, López A, Vilanueva MC, Andrés JA, Machés F. La barrera hemato-nerviosa en los nervios periféricos. Rev Esp Anestesiol Reanim 2003; 50: 80-6.
Brock JE, Perez-Atayde A, Kozakewich HP, Richkind KE, Fletcher JA, vargas SO. Cytogenetic aberration in perineurioma. Variations with subtype. Am J Surg Pathol 2005; 29: 1164-9.
Erlandson R. The enigmatic perineurial cell and its participation in tumors and tumor like entities. Ultrastruct pathol 1991; 15: 335-51.
Erlandson R, editor. Diagnostic Transmission Electron Microscopy of tumors: With clinicopathological, immunohistochemical and cytogenetic correlation. New York: Raven Press. 1994.
Sada-Mier y Terán A, Padilla-Longoria R, Toussaint-Caire S, Ortiz-Hidalgo C. Expresión difusa de EMA y GLUT-1 en tres casos de neurofibromas. Evidencia inmunohistoquímica de diferenciación perineural extensa. Rev Esp Patol 2005; 38: 83-6.
Lazarus SS, Trombetta LD. Ultrastructural idenitifcation of a benign perineurial cell tumor. Cancer 1978; 41: 1823-9.
Giannini C, Scheithauer B, Jenkins R. Soft tissue perineurioma. Evidence for an abnormality of chromosome 22, criteria for diagnosis and review of the literature. Am J Surg Pathol 1997; 21: 164-73.
Emory T, Scheithauer B, Hirose T, Wood M, Onofrio B, Jenkins R. Intraneural perineurioma: a clonal neoplasm associated with abnormalities of chromosome 22. An J Clin Pathol 1995; 103: 696-704.
Hirose T, Scheitauer BW, Sano T. Perineurial malignant Peripheral nerve sheath tumor (MPNST). A Clinicopathological and ultrastructural study of seven cases. Am J Surg Pathol 1998; 1368-78.
Folpe AL, Billings SD, McKenny JK, Walsh SV, Nusrat A, Weiss SW. Expression of claudin-1, a recently described tight junction-associated protein, distinguishes soft tissue perineurioma from potential mimics. Am J Surg Pathol 2002; 26: 1620-6.
Theaker JM, Gatter KC, Pudle J. Epithelial membrane antigen expression by the perineurium of peripheral nerve and in peripheral nerve tumours. Histopathology 1988; 13: 171-9.
Furose M, Fujita K, Hiiragi T, Fujimoto K, Tsukita S. Claudin-1 and cludin-2: Novel integral membrane proteins localizing at tight junctions with no sequence similarity to occluding. J Cell Biol 1998; 141: 1539-50.
Hirose T, Tani T, Shimada T, Ishizawa K. Immunohistochemical demonstration of EMA/Glut1-positive perineurial cells and CD34-positive fibroblastic cells in peripheral nerve sheath tumors. Mod Pathol 2003; 16: 293-8.
Zamecnik M, Michal M, Baumruk L, Mekensnabl P. Dermatofibrosarcoma protuberans with EMA + cells. Report of a case suggesting perineurial cell differentiation. Pathol Res Pract 2002; 198: 767-75.
Alguacil-García A, Unni K, GoellnerJ. Histogenesis of dermatofibrosarcoma protuberans. Am J Clin Pathol 1978; 69: 427-34.
Frisman DM. ImmunoQuery. Rancho Mirage, California, EEUU. Fecha de última actualización: 11/08/2006 Disponible en: www.immunoquery.com.
Ortiz Hidalgo C. De León Bojorge B, de la Vega G. Utilidad del CD34 en patología quirúrgica. Patología, Revista Latinoamericana 1997; 35: 261-7.
Bisceglia M, Fisher C, Suster S, Kakakov DV, Cooper K, Michal M Tumoral, quasitumoral and pseudotumoral lesions of the superficial and somatic soft tissue: new entities and new variants of old entities recorded during the last 25 years. Part VIII: Excerpta VI. Pathologica 2005; 97: 141-57.
Monda L, Warnke R, Rosai J. A primary lymph node malignancy with features suggestive of dendritic reticulum cell differentiation. A report of 4 cases. Am J Pathol 1986; 122: 562-72.
Smith ME, Awasthi R, O’shaughennessy S, Fischer C. Evaluation of perineurial differentiation in epithelioid sarcoma Histopathology 2005; 47: 575-81.