
Vol. 39, n.º 2, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 2, 2006 |
ORIGINALES
José Darío Sánchez López1, Clara Chamorro Santos2, Javier Esquivias López-Cuervo2, Eduardo Valencia Laseca1
Hospital Universitario Virgen de las Nieves.
Servicio de Cirugía Oral y Maxilofacial. Servicio de Anatomía Patológica.
Granada.
1 Servicio de Cirugía Oral y Maxilofacial.
2 Servicio de Anatomía Patológica.
dario@fundacionhvn.org
RESUMEN
I. Introducción: Se realiza un estudio sobre los principales parámetros histopatológicos en el carcinoma escamoso de lengua, neoplasia que representa hoy día un auténtico problema de salud pública. II. Material y Métodos: 1. Diseño: Estudio retrospectivo de base hospitalaria integrado por 60 pacientes desde enero de 1990 a julio de 1997 (seguimiento mínimo de 8 años). 2. Variables: Filiación del paciente (edad y sexo) y factores histopatológicos (diferenciación tumoral, índice mitótico, eosinofilia peritumoral, infiltración perivascular y perineural y patrón de crecimiento). 3. Estadística: Análisis descriptivo y estadística inferencial mediante test de chi-cuadrado y test exacto de Fischer (p<0,05). III. Resultados: Se obtuvieron un 26,66% de mujeres frente a un 73,34% de hombres, con una edad media de 58 años (Rango de 88-21). La invasión perineural y perivascular se asoció con un patrón de crecimiento tumoral tipo II (8.4; p=0,01 y 9,74; p=0,03). Se obtuvo independencia estadística entre índice mitótico y diferenciación tumoral. IV. Conclusiones: Se ha determinado una alta asociación entre la infiltración perivascular y perineural con el patrón de crecimiento tipo II. Estos hallazgos permiten elaborar un protocolo aplicable de forma rutinaria en la evaluación del carcinoma epidermoide lingual.
Palabras clave: carcinoma de células escamosas, lengua, parámetros histopatológicos.
SUMMARY
I. Introduction: A study is made of the main histopathological parameters in squamous cell carcinoma of the tongue. This neoplasm represents nowadays a outstanding health problem. II. Material and Methods: 1. Design: A hospital population retrospective study over 60 patients since January-1990 to July-1997 (minimal follow-up of 8 years). 2. Variables: Patient data (age and sex) and histopathological factors (tumoral grading, mitotic index, peritumoral eosinophilic, vascular and perineural infiltration, growth pattern). 3. Statistics: Descriptive analysis. Association between variables was assessed with chi-square test and Fischer exact test. (p<0.05). III. Results: There were 26.66% females and 73.34% males, with a mean age of 58 (range 88-21). The perineural and perivascular infiltration was associated with a tumoral pattern type II (8.4; p=0.01 and 9.4; p=0.03). Mitotic Index and tumoral grading were independent parameters. IV. Conclusions: We determine a high association between perivascular and perineural infiltration with the tumoral pattern type II. This protocol may be applied as routine for an accurate evaluation of the squamous cell carcinoma of the tongue.
Key words: squamous cell carcinoma, tongue, histopathological parameters.
I. INTRODUCCIÓN
El carcinoma epidermoide o carcinoma de células escamosas es la entidad que se presenta con mayor frecuencia en cavidad oral y orofaringe. Aunque su incidencia es menor que la de otras neoplasias, su importancia radica en su elevada mortalidad y en las graves alteraciones que, bien por el tumor en sí o debido al tratamiento se producen en el paciente (1).
En series publicadas en Estados Unidos, la lengua es el lugar donde asientan aproximadamente la mitad de todos los carcinomas intraorales, afectando en segundo lugar a suelo de boca con una prevalencia de un 35% (2). La frecuencia del mismo se encuentra en aumento, especialmente en Bélgica, Alemania, España y países del Este de Europa (3). Es por tanto una entidad que constituye actualmente un problema sanitario de primer orden.
Estudios recientes (4) muestran un escaso índice de supervivencia global a los cinco años, inferior al 50%, derivado de su diagnóstico tardío, y la diseminación metastásica cervical incontrolada que representa una mortalidad del 85%, especialmente si consideramos el hecho de que la evaluación clínica del mismo, incluso con el apoyo de técnicas de imagen, permite únicamente una detección del 68% de los casos (5).
Localización tumoral, tamaño tumoral y profundidad tumoral (6) son los principales factores que determinan el riesgo de afectación cervical. No obstante, la tendencia actual es la de considerar otros parámetros, especialmente sus características histopatológicas (7), como factores que condicionan de forma decisiva el comportamiento y por tanto el pronóstico tumoral.
En el presente estudio pretendemos evaluar la relación existente entre dichos factores en el carcinoma lingual de células escamosas con la finalidad de caracterizar de la forma más fiable posible un mismo carcinoma en función de sus peculiaridades histológicas.
II. OBJETIVOS
1. Objetivo principal
Caracterización de las variables histopatológicas del carcinoma epidermoide lingual.
2. Objetivos secundarios
2.1. Análisis de frecuencias de factores histopatológicos.
2.2. Establecer la correlación entre los distintos parámetros.
III. MATERIAL Y MÉTODOS
3.1. Diseño
Estudio retrospectivo de base hospitalaria constituido por una cohorte integrada por pacientes diagnosticados y tratados de carcinoma epidermoide lingual, durante el periodo de tiempo comprendido entre enero de 1990 y julio de 1997, en los Departamentos de Cirugía Oral y Maxilofacial y Anatomía Patológica del Hospital Universitario Virgen de las Nieves, Granada, determinando 1997 como año final del estudio (tiempo mínimo de seguimiento de 8 años).
Para ello se revisaron 120 historias clínicas, seleccionándose 60 historias en base a los siguientes criterios:
1. Pacientes afectos de carcinoma epidermoide lingual como primer tumor intraoral.
2. Cirugía como tratamiento inicial.
3. Determinación de márgenes quirúrgicos libres.
4. Acceso a la historia clínica y bloque parafinado del tumor.
La recogida de datos obtenidos de sus correspondientes historias clínicas, fue realizada por un único observador y la evaluación histopatológica de la pieza quirúrgica fue supervisada de forma independiente por dos médicos especialistas en anatomía patológica sin conocimiento previo de las características del paciente ni del tumor.
3.2. Variables
3.2.1. Filiación del paciente: edad (variable cuantitativa) y sexo (variable dicotómica).
La edad del paciente es la correspondiente al momento de su primera consulta en el Servicio de Cirugía Oral y Maxilofacial, ésta es aquella en la que algún miembro del Servicio realiza la historia clínica, o bien es presentado en el Comité Oncológico por alguno de sus miembros integrantes.
3.2.2. Parámetros histopatológicos: Factores histológicos asociados al tumor y Factores histológicos que evalúan la interfase tumor-huésped.
3.2.2.1. Grado de diferenciación tumoral, siguiendo la clasificación de Broders (8).
— Bien diferenciado (BD).
— Moderadamente diferenciado (MD).
— Pobremente diferenciado (PD).
Se ha considerado como variable ordinal.
3.2.2.2. Número de mitosis se valoró como variable ordinal, según la siguiente escala (Crissman y Zarbo 1990) (9).
— Leve (0-1 mitosis/8 campos/40x).
— Moderado (2-5 mitosis/8 campos/40x).
— Intenso (>5 mitosis/8 campos/40x).
3.2.2.3. Eosinofilia peritumoral (TATE) o eosinofilia tisular asociada al tumor se ha tipificado como variable ordinal de la siguiente forma (Millian et al 1993) (10).
— <5/8 campos/40x.
— 5-15/ 8 campos/40x.
— 16-25/8 campos/40x.
— <50/8 campos/ 40 x.
3.2.2.4. Invasión vascular e invasión perineural se han clasificado como variables dicotómicas.
3.2.2.5. Patrón de infiltración tumoral fue considerado como variable cuantitativa, siguiendo la clasificación expuesta por Umeda et al (1993) (11), en tres modalidades.
I. Límites romos y bien definidos.
II. Nidos ó cordones celulares infiltrantes, aislados y delimitados.
III. Infiltrado difuso de células aisladas en reguero.
3.3. Procedimientos de laboratorio
Las muestras histológicas se procesaron en el Servicio de Anatomía Patológica del mismo centro hospitalario mediante fijación en formol al 10% durante 12-24 horas, descripción macroscópica de la muestra y tallado de la pieza e inclusión en bloques de parafina, catalogados por su número de registro, número de bloque y año en curso.
Los bloques ya parafinados se cortan a un espesor de 4 a 6 micras practicándose para el estudio tisular, la técnica histopatológica mediante tinción de los cortes con hematoxilina-eosina, seleccionando aquellas muestras más representativas del tumor para efectuar el posterior análisis.
3.4. Procedimientos estadísticos
Se practicó en primera instancia un análisis univariante de la población muestral consistente en un análisis de frecuencias y en un análisis descriptivo (medidas de posición y dispersión) según la naturaleza de las variables incluidas.
Una vez conocida la naturaleza y la distribución de cada una de las variables de estudio, el siguiente paso consistió en realizar una análisis bivariante, en el que se establecieron diferentes líneas de actuación en función de la naturaleza de las variables (Chi-cuadrado o test exacto de Fischer, según los casos) (12).
El nivel de significación estadística considerada ha sido de p<0,05.
El análisis de los datos se llevó a cabo mediante el paquete estadístico SPSS 11.5.
IV. RESULTADOS
4.1. Estadística descriptiva
4.1.1. Descripción de datos personales: El 26,66% correspondieron a mujeres y el 73,34% a hombres. Edad media de 58, Rango de 67 (88-21) y desviación estándar de 14.
4.1.2. Descripción de parámetros histopatológicos.
4.1.2.1. Grado de diferenciación tumoral.
El mayor porcentaje se obtuvo en la variante BD (75%), siendo escasos los tumores que exhibieron un patrón pobremente diferenciado (3,3%).
4.1.2.2. Eosinofilia peritumoral.
Es de destacar que la mitad de la muestra exhibió un grado de TATE en su forma leve (50%). El grado intenso representó un 21,7%.
4.1.2.3. Patrón de infiltración tumoral.
La forma de infiltración tumoral más frecuente es en forma de límites romos y bien definidos, forma I según la clasificación de Umeda, representando el 61,7% de la muestra.
El porcentaje de tumores que exhiben una forma de invasión a modo de células en reguero, dato de mal pronóstico histológico, es escaso (10%).
4.1.2.4. Índice de mitosis.
Tras la clasificación de este parámetro en tres categorías (leve, moderado e intenso), no se detectó un índice mitótico de grado leve en ninguna de las piezas histológicas estudiadas.
El porcentaje entre las dos categorías restantes, moderado e intenso fue superior en esta última (60% vs. 40%).
4.1.2.5. Invasión vascular e invasión perineural.
La invasión vascular se detectó en el 8,3% y la invasión perineural en un 6,7%.
4.2. Estadística inferencial
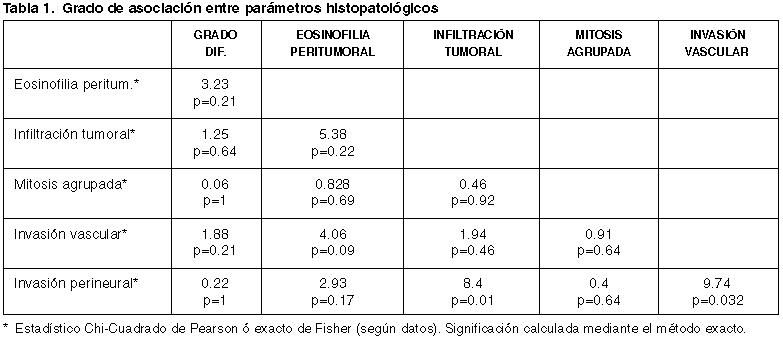
4.2.1. Grado de asociación entre parámetros histopatológicos.
La presencia de invasión perineural se asocia de forma estadísticamente significativa con el patrón de infiltración tumoral tipo II (8.4; p=0,01) y con la existencia de invasión vascular (9,74; p=0,03).
No puede descartarse la asociación entre esta última variable y el grado leve de eosinofilia peritumoral (4,06; p=0,09), hecho probablemente atribuible al tamaño muestral.
Es de destacar la total independencia y mínima asociación detectada entre las variables de grado de diferenciación e índice mitótico (0,06; p=1) (tabla 1).
V. DISCUSIÓN
En oncología, se definen como factores pronósticos un conjunto de síntomas y signos que informan sobre el posible futuro de un enfermo en cuanto a supervivencia global, respuesta terapéutica, intervalo libre de enfermedad o aparición de una complicación (13). Dichos factores permiten el establecimiento de grupos homogéneos de pacientes con un pronóstico similar que permitan la aplicación de procedimientos terapéuticos lo más parecidos posibles.
Por tanto, el pronóstico del carcinoma epidermoide lingual depende de una serie de variables histopatológicas que requieren de su correcta sistematización y que han de ser correctamente sistematizadas para la precisa comprensión del pronóstico de dicho carcinoma.
La relación más evidente que se desprende en nuestro estudio es la estrecha relación entre el grado de infiltración tumoral tipo II con respecto de los parámetros de invasión vascular e invasión perineural (8.4; p=0,01 y 9,74; p=0,03 respectivamente).
En la identificación patológica de la pieza tumoral, los tres parámetros son datos de mal pronóstico.
El patrón mediante el cual el carcinoma epidermoide invade el tejido circundante es uno de los principales parámetros histológicos predictores de su comportamiento biológico. Como se ha mostrado previamente, la invasión del estroma puede adoptar tres modalidades (11).
Los tumores que presentan un frente de invasión tipo II ó III, más frecuentes en lengua, suelo de boca y orofaringe, tienen una mayor tendencia a invadir vasos, nervios y metastatizan con mayor facilidad que aquellos que lo hacen siguiendo el patrón I. El fenómeno de invasión tumoral precisa de una compleja secuencia de procesos, incluyendo entre ellos la ruptura de los componentes tisulares estructurales que actúan a modo de barrera. La lámina basal del epitelio y de los vasos sanguíneos es uno de los componentes que impiden la progresión tumoral. La lámina basal se compone predominantemente de laminina y colágeno tipo IV, junto con otros elementos proteicos. En las células tumorales se han identificado cierto número de enzimas proteolíticas, responsables de la destrucción de estos componentes (14,15).
Según algunos autores (16), el mecanismo determinante sería la producción de lámina basal (compuesta fundamentalmente por laminina y colágeno tipo IV), de tal forma que aquellos tumores que invaden a modo de finos cordones ó células aisladas, raramente se encuentran delimitados por lámina basal. De este modo, la distribución de la lámina basal podría considerarse como marcador de diferenciación, y su presencia indicaría falta de invasión tumoral activa.
Tal y como demostramos en nuestro estudio, en consonancia con otros autores (16,17) aquellos tumores que presentan un frente de invasión tipo II ó III, tienen mayor tendencia metastatizante que aquellos que lo hacen siguiendo el patrón I, de hecho autores como Tideman et al (18), consideran que tanto el patrón de invasión como el diámetro de los vasos linfáticos alrededor del tumor con factores determinantes en la predicción de nódulos linfáticos cervicales metastásicos.
Esta asociación es comprensible ya que en la cascada metastásica, la invasión de los vasos angiolinfáticos aumenta la probabilidad de desarrollar una metástasis, con un impacto en la supervivencia, según Close et al. (19) , en un estudio realizado en 65 tumores de cavidad oral y orofaringe, determinó que la invasión microvascular es el parámetro que tiene mayor impacto en la supervivencia (inferior al 51% en el primer año), pudiéndose establecer una correlación con la recurrencia local y metástasis cervicales (77%).
La invasión perineural ó invasión del epineuro se ha considerado como un factor que incrementa las recidivas locales y el índice de metástasis (20). Ambos parámetros se correlacionan estrechamente con tumores que exhiben un patrón II y III. Según un estudio realizado en 85 carcinomas de orofaringe, dicho factor se comportó como un marcador de mal pronóstico, indicativo de una mayor capacidad metastásica (21).
El hallazgo en la periferia de un tumor de células linforreticulares es común en las neoplasias malignas, lo que traduce un mecanismo de defensa cito-inmunológico por parte del huésped. De hecho, la presencia de un infiltrado linfoplasmocitario en el estroma del tumor es considerado como un factor pronóstico favorable, probablemente debido a la buena respuesta inmunológica del huésped frente al tumor.
Actualmente se ha considerado la proporción de eosinófilos en el infiltrado inflamatorio, eosinofilia tisular asociada al tumor (TATE), como un indicador de buen pronóstico tumoral (10), lo cual traduciría un mecanismo de defensa citoinmunológico por parte del huésped, no teniendo un carácter local, sino siendo la expresión de la liberación del factor eosinofilotáctico de la anafilaxia (ECF-4), liberado por los mastocitos y aislados en otros procesos patológicos tales como el carcinoma de pulmón o linfoma de Hodgkin (9). La asociación determinada en el presente estudio entre bajos niveles de TATE e invasividad vascular (4,06; p=0,09) pone de manifiesto que una respuesta deficitaria por parte del huésped se asocia con un mayor incremento del poder metastásico (22), si bien sería necesario un mayor volumen muestral para corroborar este fenómeno.
De todos los parámetros histopatológicos considerados, aquel que presenta un valor pronóstico más escaso es el grado de diferenciación, siguiendo en nuestro estudio la clasificación de Broders (8). Esta discordancia entre la graduación histológica y el comportamiento biológico tumoral, se explicaría en relación a la subjetividad de dicho método, que ha provocado la pérdida de consenso en relación con su valor pronóstico (23), ya que en el mismo no se tienen en cuenta ciertos parámetros con carácter pronóstico que evalúan la interfase tumor-huésped. De hecho es la variable que presenta menor índice de asociación estadística con respecto de las restantes, especialmente con el índice mitótico (IM), exponente del componente proliferativo tumoral (24) (0,06; p=1), datos que reflejan una total independencia entre ambas.
Actualmente se considera más efectivo el sistema propuesto por Bryne (25) o «Sistema de graduación de frente tumoral» en el que se introducen un pequeño número de variables y que se aplica únicamente en la interfase entre el tumor y el huésped (tabla 2).

En la evaluación del IM se han empleado distintos métodos. Yuen et al (26) afirmó que un patólogo experto puede obtener resultados reproducibles mediante el recuento de figuras mitóticas por campo de alto aumento. Simpson et al (27) por el contrario, propuso un enfoque diferente que permitía minimizar la variabilidad en la estimación de la mitosis a través de la aplicación de una formulación matemática. La variabilidad en el recuento mitótico entre distintos patólogos se debería a dos factores: variabilidad de la celularidad tumoral y variabilidad del campo elegido para realizar el análisis (27).
En resumen, podemos afirmar que la correcta sistematización de los factores histopatológicos implicados en la histogénesis del carcinoma lingual proporciona una información determinante en la comprensión del comportamiento de la neoplasia y por tanto, del pronóstico y en la elaboración de una terapéutica individualizada.
La evaluación de dichos parámetros es aplicable en cualquier Servicio de Anatomía patológica sin que suponga un coste adicional, en recursos humanos y/o económicos. La progresiva implantación del mencionado protocolo tiene como finalidad unificar criterios en la caracterización tumoral y elaborar una base de datos homogénea con la finalidad de realizar futuros estudios multicéntricos entre distintos centros hospitalarios.
V. CONCLUSIONES
1. La presencia de invasión perivascular y perineural se encuentra en estrecha relación con aquellos tumores que exhiben un patrón de diseminación en forma de cordones aislados (tipo II).
2. El grado de diferenciación tumoral, representa actualmente la variable histopatológica de menor influencia en el pronóstico del carcinoma epidermoide lingual, pese a que en su gran mayoría (75%), los carcinomas evaluados presentan una forma bien diferenciada.
VI. BIBLIOGRAFÍA
Boring CC, Squires TS, Tong T. Cancer Statistics. Cancer J Clin 1994; 44: 7-26.
Neville BW, Damm DD, Allen CM et al. Epithelial Pathology. In Oral and Maxillofacial Pathology. Philadelphia: Wb Saunders. 1995. p. 416-42.
Berrino F, Sant A, Verdecchia R, et al . Survival of Cancer Patients in Europe International Agency for Research on Cancer European Commission 1995; 122: 132-36.
Parkin DM, Whelan SL, Ferlay J et al. Cancer Incidence in Five Continents. Vol VIII. IARC Scientific Publications No. 155 Lyon: IARC. 2000.
Woolgar JA. T2 carcinoma of the tongue: The histopathologist´s perspective. Br J Oral Maxillofac Surg 1999; 37: 187-93.
Spiro RH, Huvos AG, Wong GY et al. Predictive value of tumor thickness in squamous carcinoma confined to the tongue and floor of the mouth. Am J Surg 1986; 152: 345-50.
Aenneroth G, Hansen LS. A methodologic study of histologic classification and grading of malignancy in oral squamous cell carcinoma. Scand J Dent Res 1984; 92: 448-68.
Broders AC. Carcinoma: Grading and practical application. Arch Pathol 1926; 2: 376-81.
Crissman JD, Zarbo RJ. Squamous cell carcinoma of the upper aerodigestive tract: Histologic parameters with prognostic value. En: Fee W, Goepfert H, Johns M, Strong E, Ward P, eds. Head and Neck Cancer. Vol. 2. Toronto: B.C Decker. 1990.
Million RR, CassiniNJ, Wittes RE. Cancer of the head and neck. En: De Vita VT, Hellman S, Rosenberg SA (eds). Cancer 1990. Principles and Practice of Oncology. Philadelphia: Lippincott. 407-506.
Umeda M, Yokoo S, Take Y et al. Lymph node metastases cell carcinoma of the oral cavity: Correlation between histologic features and the prevalence of metastasis. Head Neck 1993; 14: 263-72.
Altman DG. Practical statistics for medical research. London: Chapman and Hall. 1991.
González Barón. Importancia de los factores pronósticos en Odontología. En: González Barón. Factores pronósticos en odontología. Madrid: Ed. Interamericana-McGraw Hill. 1994. p. 1-21.
Woolgar JA. T2 carcinoma of the tongue: The histopathologist perspective. Br J Oral Maxillofac Surg 1999; 37: 187-93.
Al Rajhi N, Khafaga Y, El Husseiny J et al. Early stage carcinoma of oral tongue: prognostic factors for local control and survival. Oral Oncol 2000; 36: 508-14.
Yamamoto E, Miyakawa, Kohama G. Mode of invasion and limph node metastasis in squamous cell carcinoma of the oral cavity. Head Neck Surgery 1984; 6: 938-47.
Klijanienko J, el Naggar AK, de Braund F et al. Tumor vascularization, mitotic index, histopathologic grade, and DNA ploidy in the assesment of 114 head and neck squamous cell carcinomas.Head Neck 1995; 12: 145-58.
Tideman H. Relation between lymphatic vessel diameter and clinicopathologic parameters in squamous cell carcinomas of the oral region. Int J Oral Maxillofc Surg 2000; 29: 233-34.
Close LG, Burns DK, Reisch J et al. Microvascular invasion in cancer of the oral cavity and oropharynx. Arch Otolaryngol Head Neck Surg 1997; 113: 1191-5.
Brown B, Barnes L, Mazariegos J et al. Prognostic factors in mobile tongue and floor of the mouth carcinoma. Cancer 1995; 64: 1195-202.
Bundgaard T, Bentzen SM, Wildt J et al. Histopathologic, stereologic, epidemiologic and clinical parameters in the prognostic evaluation of squamous cell carcinoma of the oral cavity. Head neck 1996; 18: 142-52.
Martínez-Conde R, Aguirre JM, Burgos JJ et al. Factores clínico-patológicos en el carcinoma de células escamosas inicial de lengua y suelo de boca, en Vizcaya. Med Oral 2000; 6: 87-91.
Roland N, Caslin A, Nash J et al. Value of grading squamous cell carcinoma of the head and neck. Head Neck 1992; 14: 226-29.
Martínez-Gimeno C, Moro Rodríguez E, Navarro Vila C, López Varela C. Squamous cell carcinoma of the oral cavity: A clinicopathologic scoring system for evaluating risk of cervical lymph node metastasis. Laryngoscope 1995; 105: 728-33.
Bryne M. A multivariate study of the prognosis of oral squamous cell carcinomas. Cancer 1991; 68: 1994-8.
Yuen APW, Lam KY, Chan ACL et al. Clinicopathological analysis of local spread of carcinoma of tongue. Am J Surg 1998; 175: 242-44.
Simpson JF, Dutt PL, Page DL. Expression of mitosis per thousand cells and cell density in breast carcinomas. Hum Pathol 1992; 23: 608-11.