
Vol. 39, n.º 2, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 2, 2006 |
ORIGINALES
Francisco Javier Torres Gómez1, Francisco Javier Torres Olivera2
1 Servicio de
Anatomía Patológica. Hospital Punta de Europa. Algeciras (Cádiz).
2 Departamento de Anatomía Patológica. Hospital Universitario Virgen
Macarena. Sevilla.
RESUMEN
Introducción: En numerosos tumores malignos entre los que se encuentra el carcinoma ductal infiltrante mamario se ha evidenciado que la adquisición de su capacidad infiltrativa y metastásica depende de la angiogénesis. Por ello, la valoración cuantitativa de la densidad vascular tumoral ha sido considerada de interés por su probable valor pronóstico. La investigación en este sentido ha obtenido resultados contradictorios que parecen depender, al menos en gran parte, de la heterogeneidad de la metodología utilizada. Hemos comparado diferentes métodos de recuento vascular recomendados en la literatura a fin de obtener el más sensible, específico y práctico. Material y métodos: Se ha determinado la densidad vascular tumoral en 189 pacientes con carcinoma ductal infiltrante (NOS) sobre cortes histológicos teñidos inmunohistoquímicamente con CD31 mediante seis métodos de valoración. Resultados: El método más sensible y específico de recuento vascular ha sido el realizado a 400x en el mejor punto caliente (área de mayor densidad vascular intratumoral).
Palabras clave: angiogénesis, recuento vascular, carcinoma ductal infiltrante.
SUMMARY
Introduction: In many tumors (including invasive ductal carcinoma of the breast) invasive and metastatic ability depends on angiogenesis; therefore, tumoral vascular density evaluation is considered of interest because of its possible prognostic value. Investigation results are controversial depending on the method used. We have compared the different methods recommended in the literature in order to find the most suitable one. Material and methods: We have determined the tumoral vascular density in 189 patients with invasive ductal carcinoma (NOS) of the breast using six different methods in histologic preparations immunohistochemicaly stained with CD31 immunohistochemically stained slides. Results: The most sensitive and specific method has been the one using 400x in the best hot spot.
Keywords: angiogenesis, vascular counting, invasive ductal carcinoma.
INTRODUCCIÓN
Se ha demostrado experimentalmente que el crecimiento tumoral in vitro e in vivo es dependiente de la angiogénesis (1,2). En bastantes tumores malignos se han establecido dos fases cronológicas: la fase prevascular, de larga duración, en la que el crecimiento tumoral y el potencial metastático son limitados, y la fase vascular, iniciada con la angiogénesis, caracterizada por un crecimiento tumoral rápido no acompañada necesariamente de un potencial metastático alto. La adquisición del potencial invasor y metastático tumoral depende de la angiogénesis (3-8). El aumento de la masa tumoral, la neoformación vascular y el carácter fenestrado de los neovasos favorecen el paso de células tumorales a la circulación sanguínea (4) por lo que el éxito de la metástasis depende, al menos en parte, del número de células neoplásicas circulantes (9,10). La potencialidad angiogénica de las células tumorales se encuentra distribuída de forma heterogénea en los diferentes clones celulares que integran el tumor, por lo que el éxito del proceso metastásico y su posterior crecimiento en el órgano diana, dependerá de la capacidad angiogénica de los clones celulares que pasen a la circulación sistémica (8).
La valoración cuantitativa de la angiogénesis como factor predictivo de metástasis se utilizó por primera vez en el melanoma (11) y posteriormente en otros órganos (2,13). La inmunohistoquímica ha facilitado la cuantificación vascular mediante la utilización de marcadores vasculares específicos, delimitando las áreas de mayor densidad vascular (puntos calientes) (8,14) e incluso han permitido diferenciar los vasos neoformados de los preexistentes (15).
Numerosas evidencias sugieren que el carcinoma mamario es un tumor dependiente de la angiogénesis (2,4,6,16-18). Su expresión es evidente en estadios preinvasivos (19-21) y es más llamativa cuando el fenotipo del tumor es de alto grado (21) y en los frentes de crecimiento tumoral (7,8,22-24).
Se ha demostrado que el aumento de la densidad vascular (DV) en el cáncer mamario es un indicador pronóstico significativo, independiente del estatus ganglionar axilar (6-8,17,24,26,27). Las pacientes con ganglios axilares negativos muestran menor DV que las que tienen metástasis y existe una relación directa entre aumento de la misma y número de ganglios afectados (14). Asimismo, se ha relacionado la DV con el tamaño tumoral (24,26) y supervivencia (27,28). Todos estos hechos apoyan la fiabilidad de la angiogénesis como factor pronóstico en el cáncer de mama(7,8,14,17,27,28). Otros autores sin embargo, relacionan la DV con el grado histológico tumoral (30) pero no con otros parámetros clásicos (31-36) ni con la supervivencia (30).
Estas discrepancias en los resultados obligan a investigar las causas de las mismas. Diferentes marcadores vasculares han sido utilizados en la identificación de los puntos calientes, por lo que puede ser una de las causas de desacuerdo (37).
Existen diferentes patrones angiogénicos y diferente expresión de antígenos endoteliales dependiendo del tipo histológico de cáncer mamario (38,39), por lo que la valoración de la DV en un grupo heterogéneo de tumores mamarios puede desvirtuar los resultados. Algunos autores señalan mayor DV en los márgenes de crecimiento tumoral (8,22,23,26), mientras que otros la sitúan en la zona central del tumor (40); la elección predeterminada de una de ellas puede condicionar los resultados. La subjetividad y la variación interobservadores en la elección de los puntos calientes (8,34-36,41,42) y las técnicas de valoración microscópica y morfométrica (7,43) son factores importantes de discrepancia.
La estandarización de las técnicas de marcado y de recuento vascular, la homogenización histológica de los carcinomas a estudiar y la evaluación objetiva de las áreas de mayor DV deben conducir a una reproducibilidad aceptable de los resultados (43,44). Hemos ajustado nuestro estudio a estas premisas a fin de establecer si la angiogénesis puede ser incorporada como un factor pronóstico más en el carcinoma de mama.
MATERIAL Y MÉTODOS
Hemos utilizado para el presente estudio 332 especímenes correspondientes a biopsias con tru-cut, tumorectomías, cuadrantectomías, mastectomías y linfadenectomías axilares de 189 pacientes, remitidas al Departamento de Anatomía Patológica del Hospital Universitario Virgen Macarena entre los años 1996 y 2004. Hemos descartado los tumores multifocales, tipos histológicos diferentes al carcinoma ductal infiltrante (NOS), tumores mixtos, casos tratados previamente con radioterapia o quimioterapia, lesiones con mala expresividad antigénica y casos con estatus ganglionar desconocido. Los especimenes han sido sometidos a fijación en solución acuosa de formol al 10% durante 24 horas. En las piezas quirúrgicas, una vez fijadas, se ha medido el diámetro tumoral máximo macroscópico y se han obtenido secciones representativas que se han incluido en parafina. De los bloques obtenidos se han realizado cortes histológicos de 3 micras de espesor que se han teñido con HE. Uno de los cortes obtenido del bloque más adecuado, se ha destinado a estudio inmunohistoquímico montándolo sobre porta sialinizado, utilizando el anticuerpo frente a CD31 (monoclonal, dilución 1:50) (Concepta Byosistems S.A., Barcelona) en un procesador automático tipo VENTANA ES (Ventana Medial Systems, Tucson, Arizona, USA) utilizando el kit de detección Ventana Enhanced DAD (solución de peróxido de hidrógeno, anticuerpo biotinilado antiratón, solución de peróxido de hidrógeno, DAD, solución de sulfato de cobre, hematoxilina y fondo de contraste). El desenmascaramiento antigénico se ha realizado mediante tampón citrato a pH 6, en olla a presión durante 4 minutos. El estudio microscópico se ha realizado en un microscopio binocular Olympus BX 40 (Tokio, Japón).
Se han utilizado como grupo testigo 30 lobulillos mamarios normales, presentes en secciones de tejido mamario alejado del tumor, teñidos con CD31.
La valoración de la densidad vascular tumoral se ha realizado en dos fases:
1) Identificación de las áreas de mayor densidad vascular (puntos calientes) mediante la observación microscópica a 100x.
2) Recuento vascular; este se ha realizado en cada caso a 200 x en un campo microscópico de 0,916 mm2, a 400x en un campo microscópico de 0,229 mm2 y en tres campos microscópicos idénticos en puntos calientes diferentes, con cada uno de los aumentos referidos.
Hemos establecido un estudio comparativo (Test de Correlación de Pearson, Curva COR) entre las DV (total y media), obtenidas mediante los seis métodos de recuento vascular utilizados a fin de obtener el de mayor sensibilidad y especificidad.
RESULTADOS
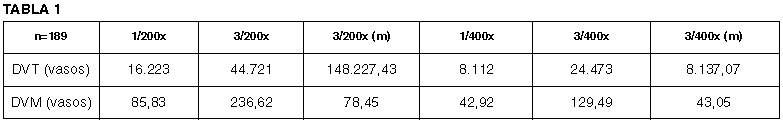
Las densidades vasculares totales (DVT) y densidades vasculares medias (DVM) obtenidas en los seis métodos de recuento vascular queda reflejada en la tabla 1.
DISCUSIÓN
La investigación del valor pronóstico de la DV en el cáncer mamario ha obtenido resultados contradictorios (9,26,30,32-34,36,37,40,41,44,46,47) y se ha responsabilizado a la heterogeneidad de la metodología utilizada de la discrepancia en los resultados (8,42). La cuantificación de la DV por 1000 células tumorales (14) minimiza las variaciones de la DV motivadas por el tamaño del campo microscópico, por la relación parénquima/estroma y por el tamaño celular, correlacionándose bien con los factores pronósticos clásicos, pero su aplicación supone un consumo de tiempo que lo hace poco práctico. El método más aplicado es la determinación de la DV sobre puntos calientes. La subjetividad en la elección de los mismos puede ser la causa principal de la disparidad de resultados (8,22,34,35,41,42,52,53). Aunque se han conseguido recuentos vasculares más objetivos utilizando técnicas morfométricas (26) y de procesado de imágenes (31,48,49,50) combinadas con el marcado inmunohistoquímico de los vasos (22,51) y se ha propuesto la selección automática de los puntos calientes para resolver la subjetividad de su elección (48,52,53), la investigación en este sentido no ha proporcionado resultados fiables (22,26,50), por lo que actualmente no existe ningún método capaz de definir objetivamente cual o cuales son los puntos calientes idóneos para determinar la DV. El marcado inmunohistoquímico vascular con un anticuerpo idóneo (8,52), la cuidadosa selección de los puntos calientes adecuados, un protocolo estricto para definir los vasos (43) y una adecuada área de observación (8,26,43) permiten obtener una DV fiable y reproducible (43,44) equiparable a la obtenida por técnicas de imagen (22).
Teniendo en cuenta estas recomendaciones hemos determinado la DV de nuestros casos contando visualmente los microvasos existentes en los mejores puntos calientes, elegidos subjetivamente según el protocolo propuesto por Weidner (8) con algunas modificaciones: se ha sustituido como marcador vascular el Factor VIII por CD31, una glicoproteína específica de la célula endotelial, localizada en sus uniones intercelulares (55,56), selectiva de los vasos sanguíneos (57,58) y ampliamente consensuada como el marcador panendotelial más sensible (52,59). Asimismo hemos modificado la metodología en la elección del mejor punto caliente. La exploración de estos a bajo aumento (40x) (8) puede resultar engañosa ya que a este aumento no es posible determinar si el marcaje inmunohistoquímico es realmente vascular o no. Las células plasmáticas muestran una tinción lineal yuxtanuclear (22,56) que cuando forman acúmulos relativamente amplios pueden dar una falsa imagen de neovascularización. Igualmente, áreas con pocos vasos de cierto tamaño, muy ramificados, pueden simular áreas de alta DV. Por estos motivos hemos preferido utilizar una observación con objetivo de 10x para señalizar los mejores puntos calientes.
Se han propuesto diferentes métodos para determinar la DV sobre puntos calientes. La Reunión del Colegio de Patólogos Americanos para consensuar factores pronósticos en el cáncer mamario, incluye la valoración de la angiogénesis dentro del grupo de factores no suficientemente estudiados en cuanto a su valor pronóstico y propone tres métodos: DV en un punto caliente, DV media en tres puntos calientes y la mayor DV en tres puntos calientes sin hacer recomendaciones sobre el tamaño del campo microscópico ni de los aumentos utilizados (60).
Diversos trabajos establecen una correlación estadísticamente significativa entre la DV en punto caliente, incidencia de metástasis y supervivencia utilizando métodos de recuento vascular diferentes (8,43). Parece establecido que la DV obtenida sobre punto caliente adquiere un valor pronóstico no alcanzado por la DV obtenida de forma global en el área tumoral (43). Existe consenso sobre la importancia crítica que adquiere el área de observación sobre la que se realiza el recuento vascular, de forma que áreas de observación de tamaño excesivo diluyen el número de vasos y áreas demasiado pequeñas establecen diferencias significativas de la DV interobservadores. La DV pierde su valor predictivo cuando el área del campo microscópico es inferior a 0,19 mm2 y alcanza su mayor valor predictivo cuando aquel mide alrededor de 0,70 mm2 (8,43). Aplicando el Test de correlación de Pearson a la DV obtenida mediante los seis métodos de recuento vascular utilizados, hemos obtenido buena sensibilidad y especificidad en todos ellos, con resultados prácticamente superpuestos (gráfico 1), salvo en el recuento vascular en los tres mejores puntos calientes a 200 x. La explicación a esta discrepancia puede ser el aumento de subjetividad al tener que elegir más de un punto caliente y a la dilución del número de vasos al ser el campo microscópico superior a los 0,70 mm2 (8,43). Estos resultados han determinado nuestra elección del recuento vascular sobre el mejor punto caliente a 400x como el método más práctico y rápido e idénticamente reproducible al obtenido a 200x en las mismas condiciones, con mayor significación estadística (8). No hemos encontrado mayor incidencia de puntos calientes en el margen de crecimiento tumoral (8) sino una distribución heterogénea de los mismos en el área tumoral (40).
Hemos obtenido una DV constante, así como una relación homogénea con las áreas acinares y el estroma en los lobulillos mamarios normales (61) por lo que hemos utilizado los recuentos vasculares en 30 lobulillos mamarios normales como grupo testigo. La DVM obtenida es significativamente menor (14±3,40 vasos) que la observada en los tumores (figs. 1 y 2).
BIBLIOGRAFÍA
Folkman J, Klagsbrun M. Angiogenic factors. Science: 1987; 235: 442-7.
Folkman J, Watson K, Ingber D et al. Induction of angiogenesis during the transition from hyperplasia to neoplasia. Nature 1989; 339: 58-61.
Aonuma M, Saeki Y, Akimoto T et al. Vascular endotelial growth factor overproduced by tumor cells acts predominantly as a potent angiogenic factor contributing to malignant progression. Int J Exp Pathol 1999; 80: 271-81.
Guinebretiere J. Angiogenesis and breast neoplasm. The pathologist-s point of view. Gynecol Obstet Fertil 2005; 33: 140-6.
Huang B. Roles of main pro and anti-angiogenic factors in tumor angiogenesis. World J Gastroenterol 2004; 10: 467-70.
Vartanian R, Weidner N. Correlation of intratumoral endothelial cell proliferation with microvessel density (tumour angiogenesis) and tumour cell proliferation in breast carcinoma. Am J Pathol 1994; 1444: 1188-94.
Weidner N, Semple J, Welch W et al. Tumour angiogenesis and metastasis correlation in invasive breast carcinoma. N Engl J Med 1991; 324: 1-8.
Weidner N. The relationship of tumour angiogenesis and metastasis with emphasis on invasive breast carcinoma. Adv Pathol Lab Med 1992; 5: 101-21.
Fox S, Leek R, Bliss J et al. Association of tumor angiogenesis with bone marrow micrometastasis in breast cancer patients. J Natl Cancer Inst 1997; 14: 1044-9.
Liotta L, Kleinerman J, Saidel G. The significance of hematogenous tumor cell clumps in the metastasic process. Cancer Res 1976; 36: 889-94.
Srivastava A. The prognostic significance of tumor vascularity in intermediate, tthicness (0.76-4.0 mm thick) skin melanoma. Am J Pathol 1988; 133, 419-23.
Frangou E, Lawson J, Kanthan R. Angiogenesis in male breast cancer. World J Surg Oncol 2005; 3: 16.
Sharma S, Sharma M, Sarkar C. Morphology of angiogenesis in human cancer: a conceptual overview, histopronostic perspective and significance of neoangiogenesis. Histopathology 2005; 46: 481-9.
Laforga J, Aranda F. Angiogenic index: a new method for assessing microvascularity in breast carcinoma with possible prognostic implications. Breast J 2000; 6: 103-7.
Kakolyris S, Fox S, Koukourakis M et al. Relationship of vascular maturation in breast cancer blood vessels to vascular density and metastasis, assessed by expression of a novel basement membrane component, LH39. Br J Cancer 2000; 82: 844-51.
Edel M, Harvey J, Papadimitriou J. Comparison of vascularity and angiogenesis in primary invasive mammary carcinomas and in their respective axillary lymph node metastasis. Clin Exp Metastasis 2000; 18: 695-702.
Gasparini G. Clinical significance of determination of surrogate markers of angiogenesis in breast cancer. Crit Oncol Hematol 2001; 37: 97-114.
Rak J, Filmus J, Kerbel R. Reciprocal paracrine interactions between tumor cells and endothelial cells: the «angiogenic progression« hypothesis. Eur J Cancer 1996; 32: 2438-50.
Heffelfinger S, Yassin R, Miller M et al. Vascularity of proliferative breast disease and carcinoma in situ correlates with histological features. Clin Cancer Res 1996; 11: 1873-8.
Santinelli A, Baccarini M, Colanzi P et al. Microvessel quantification in intraductal and early invasive breast carcinoma. Analyt Quant Cytol Histol 2000; 2: 277-84.
Zolota V, Gerokosha A, Melachrinou M et al. Microvessel density, proliferating activity, p53 and bcl2 expression in «in situ» ductal carcinoma of the breast. Antocancer Res : 1999; 19: 3269-327.
Beliën J, Somi S, De Jong J et al. Fully automated microvessel counting and hot spot selection by image processing of whole tumour sections in invasive breast cancer. J Clin Pathol 1999; 52: 184-92.
Fox S, Gatter K, Bicknell R et al. Relationship of endothelial cell proliferation to tumor vascularity in human breast cancer. Cancer Res 1993; 18: 4161-3.
Fox B, Gatter K, Harris. Tumor angiogenesis. J Pathol 1996; 179: 232-7.
Edel M, Robbins P, D-Antuono M et al. Assement of endotelial cell proliferation in primary breast carcinoma and its association with axillary lymph node status. Breast 2000; 9: 28-34.
Fox S, Leek R, Weekes M et al. Quantitation and prognostic value of breast cancer angiogenesis: comparison of microvessel density, Chalkey count and computer image analisis. J Pathol 1995; 177: 275-83.
Heimann R, Fergurson D, Powers C et al. Angiogenesis as a predictor of long-term survival for patients with node-negative breast cancer. Br J Biomed Sci 1998; 3: 214-20.
Heimann R, Hellman S. Individual characterisation of the metastatic capacity of human breast carcinoma. Eur J Cancer 2000; 36: 1631-9.
Weidner N. Tumoral vascularity as a prognostic factor in cancer patients: the evidence continues to grow. J Pathol 1998; 2: 130-5.
Van Hoef M, Knox W, Dhesi S et al. Assement of tumor vascularity as prognostic factor in lymph node negative invasive breast cancer. Eur J Cancer 1993; 8: 1141-5.
Goulding H, Rashid N, Roberston J et al. Assement of angiogenesis in breast cancer: an important factor in prognosis?. Human Pathol 1995; 26: 1196-200.
Khanuja P, Fregene T, Gimotty P et al. Angiogenesis does not predict recurrence in patients with primary breast cancer. Proc Am Soc Clin Oncol 1993; 12: 67.
Mayer M, Seshadri R, Raymond W et al. Tumor microvascularity has no independent prognostic significance for breast cancer. Pathology 1998; 2: 105-10.
Pendleton N, Pazouki S, Heerkense E et al. Relationship between different measurements of vascularity and clinico-pathological parameters in breast cancer. Anticancer Res 1998; 68: 4565-8.
Raymond J. Tumor angiogenesis inhibitors: media and scientific aspects. Presse Med.1998; 27: 1221-4.
Siitonen S, Haapasalo H, Rantala I et al. Comparison of different immunohistochemical metods in the assement of angiogenesis lack of prognostic value in a group of 77 selected node-negative breast carcinoma. Mod Pathol 1995; 8: 745-52.
Hansen S, Grabau D, Rose C et al. Angiogenesis in breast cancer: a comparative study of the observer variability of methods for determining microvessel density. Lab Invest 1998; 78: 1563-73.
Colpaert C, Vermeulen P, Benoy I et al. Inflammatory breast cancer shows angiogenesis with high endothelial proliferation rate and strong E-cadherin expression. Br J Cancer 2003; 88: 718-25.
Lee J, Kim H Jung J et al. Correlation between angiogenesis, apoptosis and cell proliferation in invasive ductal carcinoma of the breast and their relation to tumor behavior. Analyt Quant Cytol Histol 2001; 23: 161-8.
Arora R, Joshi K, Nijhawan R et al. Angiogenesis as an independent prognostic indicador in node-negative breast cancer. Analyt Quant Cytol Histol 2002; 24: 228-33.
Bossari S, Lee A, De Lellis R et al. Microvessels quantitation and prognosis in invasive breast carcinoma. Hum Pathol 1992; 23: 755-61.
Magennis D. Angiogenesis: a new prognostic marker for breast cancer. Br J Biomed Sci 1998; 3: 214-20.
De Jong J, Van Diese P, Baak J. Hot spot microvessel density and the mitotic activity index are strong additional prognostic indicators in invasive breast cancer. Histopathology 2000; 36: 306-12.
Martin L, Holcombe C, Green B et al. Is a histological section representative of whole tumour vascularity in breast cancer? Br J Cancer 1997; 1: 40-3.
Bossari S, Lee A, De Lellis R. et al. Microvessels quantitation and prognosis in invasive breast carcinoma. Hum Pathol 1992; 23: 755-61.
Hansen S, Sorensen F, Vach W et al. Microvessel density compared with Chalkley count in a prognostic study of angiogenesis in breast cancer patients. Histopathology 2004; 44: 428-36.
Simpson J, Dutt PH, Page D. Expression of mitoses per thousand cells and cell density in breast carcinomas: a proposal. Hum Pathol 1992; 23: 608-11.
Barbareschi M, Weidner N, Gasparini C et al. Microvessel density quantification in breast carcinoma. Appl Immunohistoch 1995; 375-84.
Cruz D, Valenti C, Díaz A et al. Microvessel density counting in breast cancer: slide versus digital images. Analyt Quant Cytol Histol 2001; 23: 15-20.
Van der Laak J, Wetphal J, Schalkwijk L et al. An improved procedure to quantify tumour vascularity using true colour image analysis. Comparison with the manual hot spot procedure in a human melanoma xenograf model. J Pathol 1998; 184: 136-43.
King T, Brey E, Youssef A et al. Quantification of vascular density using a semiautomated technique for inmunostained specimens. Analyt Quant Cytol Histol 2002; 24: 39-48.
Vermeulen P, Gasparini G, Fox S et al. Quantification of angiogenesis in solid human tumors: an international consensus on the methodology and criteria of evaluation. Eur J Cancer 1996; 32A: 2474-84.
Vermeulen P, Libura M, Libura J et al. Influence of investigator experience and microscopic field size on microvessel density in node-negative breast carcinoma. Breast Cancer Res Treat 1997; 42: 165-72.
Fox S, Leek R, Weekes M et al: Quantitation and prognostic value of breast cancer angiogenesis: comparison of microvessel density, Chalkey count and computer image analisis. J Pathol: 1995: 177: 275-83.
Delisser H, Christofidou-Solomidou M, Sprieter R et al. Involvement of endothelial PECAM 1/CD31 in angiogenesis. Am J Pathol 1997; 151: 671-7.
Leong A, Cooper K, Leong F. CD31. Manual of diagnostic antibodies for immunohistology. Greenwich Medical Media Ltd Ed. London. 2002: 81-2.
Horak E, Leek R, Klenk N et al. Angiogenesis, assessed by platelet/endothelial all adhesion molecule antibodies, as indicator of node metastases and survival in breast cancer. Lancet 1992; 340: 1120-4.
Parums D, Cordell J, Micklem K et al. A new monoclonal antibody that detects vascular endothelium associated antigen on routinely processed tissues sections. J Clin Pathol 1990; 43: 572-7.
Clayton F, Hopkins C. Pathologic correlates of prognosis in lymph node-positive breast carcinomas. Cancer 1993; 71: 1780-90.
Fitzgibbons P, Page D, Weaver D et al. Prognostic factors in breast cancer. College of American Pathologists Consensus Statement 1999. Arch Pathol Lab Med 2000; 124: 966-78.
Naccarato A, Viacava P, Bocci G et al. Definition of the microvascular pattern of the normal adult mammary gland. J Anat 2003; 599-603.