
Vol. 39, n.º 2, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 2, 2006 |
REVISIONES
F. Ignacio Aranda López, Gloria Peiró Cabrera, Cristina Alenda González
Servicio de Patología. Hospital General
Universitario de Alicante.
aranda_ign@gva.es
RESUMEN
La frecuente identificación de lesiones de células columnares en biopsias mamarias realizadas por microcalcificaciones mamográficas ha determinado un renovado interés en su adecuada clasificación y significado biológico y clínico. En la presente revisión se describen los criterios de clasificación, así como los principales problemas de diagnóstico diferencial, significado biológico y actitud clínica ante su diagnóstico.
Palabras clave: neoplasia mamaria, clasificación, carcinoma intraductal, células epiteliales/patología, hiperplasia, lesiones precancerosas.
SUMMARY
The frequent identification of columnar cell lesions in breast biopsies performed due to microcalcifications mammograficaly detected, has determined an increasing interest for the adequate classification, as well as their biological and clinical significance. In the present review, we describe the classification criteria and the main difficulties for the differential diagnosis, biological significance and clinical management of these lesions.
Key words: breast neoplasms, classification, carcinoma, intraductal, epithelial cells/ pathology, hyperplasia, precancerous conditions.
INTRODUCCIÓN
Las lesiones de células columnares (LCC) constituyen un espectro de alteraciones histológicas que afectan a las unidades ductolobulillares terminales (UDLTs), que se conocen desde hace décadas y han recibido múltiples denominaciones (tabla 1). En los últimos años, estas lesiones han sido objeto de renovado interés al identificarse con gran frecuencia en biopsias mamarias realizadas por microcalcificaciones mamográficas, habitualmente en relación con programas de diagnóstico precoz de cáncer de mama. Estas alteraciones incluirían desde la morfología columnar simple del epitelio de revestimiento de las UDLTs, hasta la aparición de varias capas celulares y de atipia de grado bajo, aunque sin criterios suficientes para el diagnóstico de hiperplasia ductal atípica (HDA) o de carcinoma ductal in situ (CDIS) (1). La presentación clínica más habitual es en forma de microcalcificaciones identificadas por mamografía, habitualmente multifocales preferentemente en mujeres de 35-50 años (2). La nomenclatura aplicada a estas lesiones ha sido muy variable, lo que ha contribuido a limitar el conocimiento de su significado biológico. La clasificación más pormenorizadamente descrita es la aplicada por Schnitt y cols. (1,3) (tabla 1).
CARACTERÍSTICAS ANATOMOPATOLÓGICAS DE LAS LESIONES DE CÉLULAS COLUMNARES
El cambio de células columnares (CCC) constituye la categoria más simple y se caracteriza por UDLTs que presentan grados variables de dilatación, revestidas por una o dos capas de células epiteliales columnares con núcleos uniformes, ovoides, regularmente orientados, perpendiculares a la membrana basal, con cromatina dispersa y nucleolo poco prominente (fig. 1). Las figuras de mitosis son raras. El borde luminar presenta signos de secreción apical («apical snouts») y en la luz se observa secreción que puede estar calcificada.
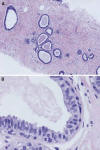
Fig. 1: Cambio
de células columnares. A) Acinos dilatados revestidos por una capa de células
columnares, en biopsia con aguja gruesa (HE x40). B) Los núcleos son ovoides,
perpendiculares a la membrana basal, y no se observan nucleolos. Los citoplasmas
presentan bordes de secreción luminar y las luces están dilatadas con contenido
(HE x400).
La hiperplasia de células columnares (HCC) es similar al CCC pero con estratificación celular superior a dos capas (fig. 2). En ocasiones pueden observarse pequeñas excrecencias micropapilares y material de secreción calcificado que forma cuerpos de psamomma.
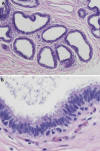
Fig. 2: Hiperplasia
de células columnares. A) Unidades ductolobulillares dilatadas (HE x100). B)
Estratificación de células columnares, perpendiculares a la membrana basal, y
bordes de secreción luminar, con ausencia de atipia nuclear (HE x400).
Atipia epitelial plana (AEP). La nueva clasificación de la OMS ha propuesto esta denominación para las lesiones de células columnares con atipia (4). Las UDLTs están revestidas por células con núcleos que tienden a ser redondos más que alargados, que no se disponen perpendiculares a la membrana basal, con leve aumento de la relación N/C. Los nucleolos pueden ser levemente prominentes y las figuras de mitosis ocasionales. También puede observarse estratificación nuclear, con núcleos ovoides perpendiculares a la membrana basal, con leve atipia, similar a la observada en los adenomas colónicos (1). Los bordes luminares suelen ser romos («apical snouts»). Las secreciones luminares pueden ser prominentes, con formación de calcificaciones laminadas tipo psamomma. La atipia nuclear constituye el marcador de la atipia epitelial plana, con núcleos redondos, agrandados, monomorfos e hipercromáticos, similares a los observados en el CDIS cribiforme de grado bajo (5). Por otra parte, las características nucleares de «alto grado» excluyen el diagnóstico de LCC (3). Las células mioepiteliales pueden suelen estar atenuadas, pero también pueden ser prominentes (5). En esta categoría se incluirían algunas lesiones previamente definidas como carcinoma «clinging» tipo monomorfo (6). Por otra parte, las lesiones con micropapilas bien desarrolladas, puentes celulares con barras y arcos, y hendiduras que presentan atipia celular deberían clasificarse como hiperplasia ductal atípica (fig. 3) o CDIS dependiendo de la importancia de las alteraciones (3,7). La aplicación de estos criterios permite una adecuada clasificación de los diferentes tipos de LCC con un alto nivel de concordancia interobservador (1).
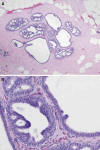
Fig. 3: Atipia
epitelial plana e hiperplasia ductal atípica. A) Unidades ductolobulillares con
acinos dilatados y revestidos por algunas capas celulares sin complejidad
arquitectural y otros con proliferación luminar (HE x40). B) Unidades dilatadas
con una capa celular y formación incipiente de micropapilas (hiperplasia de
células columnares) junto a conductos con proliferación que incluye barras y
puentes, que corresponden a hiperplasia ductal atípica (HE x200).
Algunos trabajos han puesto de manifiesto la frecuente presencia (26-60%) de LCC en biopsias con hiperplasia lobulillar atípica y carcinoma lobulillar «in situ» (2,8,9) (fig. 4), así como en otras lesiones proliferativas (fig. 5). En general, las lesiones afectan unidades lobulillares diferentes, aunque en algunos casos se ha visto la coexistencia en el mismo lobulillo. También puede observarse hasta en un 38% de las biopsias con diagnóstico de CDIS y en un 10% de carcinoma infiltrante (2) (fig. 6).
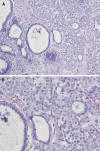
Fig. 4: Lesión
de células columnares y carcinoma lobulillar «in situ». A) Luces dilatadas con
revestimiento de células cilíndricas por borde luminar prominente, y contenido
parcialmente calcificado. Adyacentes, lobulillos ocupados por celularidad
uniforme (HE x100). B) Extensión «pagetoide» de células lobulillares a conductos
dilatados con cambios de lesión de células columnares (HE x200).
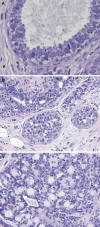
Fig. 5: Atipia
epitelial plana asociada a carcinoma lobulillar «in situ» y esferulosis
colágena. A) Acino dilatado con núcleos redondeados, hipercromáticos, con
nucleolos, y bordes de secreción prominentes (HE x400). B) Lobulillos adyacentes
ocupados por celularidad unifome que dilata los acinos (HE x200). C) Imagen de
proliferación epitelial intraductal con esférulas eosinófilas delimitas por
epitelio aplanado (HE x200).
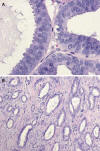
Fig. 6: Atipia
epitelial plana asociada a carcinoma tubular. A) Los núcleos son redondeados mas
que ovoides, y no están orientados respecto a la membrana basal. Se observan
algunos nucleolos. Los bordes de secreción luminar son prominentes (HE x400. B)
Imagen de carcinoma tubular, en la vecindad de la lesión anterior (HE x100).
En punción aspiración con aguja fina, la LCC presenta algunas características como grupos tridimensionales cohesivos con células mioepiteliales, células epiteliales en empalizada, calcificaciones y «snouts» que permiten la sospecha diagnóstica (10).
En relación con la inmunohistoquímica, las LCC presentan expresión fuerte de receptores de estradiol y progesterona, con positividad citoplasmática para Bcl-2. Con Ki67 la actividad proliferativa es baja, en general por debajo del 10% (3).
El diagnóstico diferencial debe establecerse con lesiones apocrinas (metaplasia, hiperplasia) que presentan rasgos apocrinos en todo el citoplasma, con núcleos redondos de nucleolo prominente. En general, las lesiones apocrinas no presentan el material de secreción ni las calcificaciones características de las LCC y suelen ser negativas para receptores de estradiol y proteína Bcl-2. Algunos autores diferencian la adenosis de conductos romos («Blunt Duct Adenosis») de la LCC; en la adenosis de conductos romos los acinos serían más irregulares con células epiteliales que presentarían menos citoplasma apical y con mayor componente mioepitelial (5). A bajo aumento, la LCC puede simular microquistes simples, por lo que es importante el examen de las características celulares a mayor aumento (3). La AEP deberá diferenciarse de la HDA y del CDIS, con los criterios previamente señalados.
SIGNIFICADO BIOLÓGICO Y CLÍNICO
Numerosos trabajos han resaltado la asociación entre LCC y CDIS o infiltrante, lo que ha sugerido a algunos autores que la LCC podría ser una lesión precursora de carcinoma, especialmente de tipo tubular (8), o una forma morfológica precoz de CDIS de grado bajo (5). La nueva clasificación de la OMS (4) incluye la AEP dentro del espectro más bajo de las neoplasias intraductales («DIN 1A»). De acuerdo con este concepto, la AEP y el CDIS de grado bajo presentan perfiles inmunohistoquímicos similares (5) y estudios recientes basados en técnicas de microdisección han demostrado un porcentaje significativo de alteraciones moleculares hasta en el 66% de las LCC con atipia (11). En relación con el riesgo relativo, las pacientes con LCC presentarían el doble de riesgo de desarrollo de carcinoma mamario, aunque la observación se basa en un bajo número de casos estando pendientes estudios epidemiológicos amplios (12). Una reciente publicación sugiere que la ausencia de expresión de receptores de estradiol en LCC aumentaría el riesgo relativo de carcinoma (13).
LCC EN LA BIOPSIA CON AGUJA GRUESA Y ESCISIONAL
Aproximadamente un 20% de las pacientes con BAG en que aparecen LCC con atipia, presentan lesiones más avanzadas en la biopsia escisional (14). Sin embargo, en la LCC sin atipia no se recomienda la escisión, salvo que existan discordancias radiológicas (15). En caso de biopsia escisional, se realizará un estudio cuidadoso para descartar la presencia de HDA o CDIS, incluyendo más tejido y con secciones adicionales. Los datos disponibles hasta la fecha indican que la LCC, una vez descartada su asociación con carcinoma, es una lesión de riesgo y no debe ser tratada como un CDIS. La actitud ante AEP en los márgenes de resección debería, por tanto, ser similar a la adoptada en otras lesiones proliferativas de riesgo, con independencia de su carácter premaligno (5). Por otra parte, en caso de asociación con CDIS, la AEP no debería tenerse en consideración para evaluar el tamaño del mismo (3).
Como conclusión, la prevalencia diagnóstica de la LCC incluyendo la AEP está aumentando debido a la aplicación de los programas de diagnóstico precoz basados en la mamografía, por lo que no es infrecuente que sea origen de problemas de diagnóstico diferencial y de actitud terapéutica. Algunos estudios recientes con microdisección apoyan la naturaleza precancerosa de la LCC, especialmente si presenta atipia (AEP). Por otra parte, el riesgo de progresión parece muy bajo, por lo que debe adoptarse una actitud conservadora. Las LCC deben ser claramente separadas de otras lesiones proliferativas como el CDIS de grado bajo que sí requiere tratamiento quirúrgico.
BIBLIOGRAFÍA
O’Malley FP, Mohsin SK, Badve S, Bose S, Collins LC, Ennis M, et al. Interobserver reproducibility in the diagnosis of flat epithelial atypia of the breast. Mod Pathol 2006; 19: 172-9.
Fraser JL, Raza S, Chorny K, Connolly JL, Schnitt SJ. Columnar alteration with prominent apical snouts and secretions: a spectrum of changes frequently present in breast biopsies performed for microcalcifications. Am J Surg Pathol 1998; 22: 1521-7
Schnitt SJ, Vincent-Salomon A. Columnar cell lesions of the breast. Adv Anat Pathol 2003; 10: 113-24.
Tavassoli F, Hoefler H, Rosai J, Holland R, Ellis I, Schnitt S et al. Intraductal proliferative lesions. En Tavassoli F, Devilee P, editors. World Health Organization Classification of Tumours Pathology of the Breast and Female Genital Organs. Lyon: IARC Press. 2003; p. 63-73.
Nasser SM. Columnar cell lesions: current classification and controversies. Semin Diagn Pathol 2004; 21: 18-24.
Eusebi V, Feudale E, Foschini MP, Micheli A, Conti A, Riva C, et al. Long-term follow-up of in situ carcinoma of the breast. Semin Diagn Pathol 1994; 11: 223-35.
Schnitt SJ. The diagnosis and management of pre-invasive breast disease: flat epithelial atypia- classification, pathologic features and clinical significance. Breast Cancer Res 2003; 5: 263-8.
Rosen PP. Columnar cell hyperplasia is associated with lobular carcinoma in situ and tubular carcinoma. Am J Surg Pathol 1999; 23: 1561.
Brogi E, Oyama T, Koerner FC. Atypical cystic lobules in patients with lobular neoplasia. Int J Surg Pathol 2001; 9: 201-6.
Saqi A, Mazziotta R, Hamele-Bena D. Columnar cell lesions: fine-needle aspiration biopsy features. Diagn Cytopathol 2004; 31: 370-5.
Dabbs DJ, Carter G, Fudge M, Peng Y, Swalsky P, Finkelstein S. Molecular alterations in columnar cell lesions of the breast. Mod Pathol 2006; 19: 344-9.
Shaaban AM, Sloane JP, West CR, Moore FR, Jarvis C, Williams EM, et al. Histopathologic types of benign breast lesions and the risk of breast cancer: case-control study. Am J Surg Pathol 2002; 26: 421-30.
McLaren BK, Gobbi H, Schuyler PA, Olson SJ, Parl FF, Dupont WD, et al. Immunohistochemical expression of estrogen receptor in enlarged lobular units with columnar alteration in benign breast biopsies: a nested case-control study. Am J Surg Pathol 2005; 29: 105-8.
Guerra-Wallace MM, Christensen WN, White RL, Jr. A retrospective study of columnar alteration with prominent apical snouts and secretions and the association with cancer. Am J Surg 2004; 188: 395-8.
Jacobs TW, Connolly JL, Schnitt SJ. Nonmalignant lesions in breast core needle biopsies: to excise or not to excise? Am J Surg Pathol 2002; 26: 1095-110.