
Vol. 39, n.º 1, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 1, 2006 |
ORIGINALES
Fernando Pascual Carpe1, Vicente Vicente Ortega1, Matilde Campos Aranda2, M.ª Josefa Yáñez Gascón1, Juana García Reverte3
Facultad de Medicina. Universidad de Murcia.
1 Cátedra de Anatomía Patológica. Facultad de Medicina. Universidad
de Murcia.
2 Departamento de Ciencias Sociosanitarias, Facultad de Medicina.
Universidad de Murcia.
3 Servicio de Cultivos Celulares (SACE). Universidad de Murcia.
vvortega@um.es
RESUMEN
Introducción: En el tratamiento del melanoma se están ensayando distintas citoquinas, entre las que destaca el IFNa, no existiendo estudios experimentales con productos homeopáticos. Material y métodos: «In vitro» la línea B16F10 fue tratada durante 24, 48 y 72 horas con IFNa/10 a 1.000.000 UI/ml y con Lymphomyosot 1/1 y 1/3 (v/v), cuantificando la viabilidad celular con el test del MTT. «In vivo» realizamos dos experimentos con 80 ratones machos a los que inyectamos 1X105 células B16F10 y tratamos con: I (PBS), II (IFNa), III (Lymphomyosot) y IV (IFNa más Lymphomyosot), realizando el estudio morfológico. Resultados: «In vitro» el IFNa a altas concentraciones inhibió el crecimiento celular y el Lymphomyosot no mostró efectos citotóxicos. «In vivo» el IFNa redujo el índice de proliferación celular y la extensión de los infiltrados inflamatorios, mientras que el Lymphomyosot originó disminución significativa de los pesos y necrosis tumorales. Conclusión: El IFNa ha mostrado citotoxicidad en ambos modelos y el Lymphomyosot ausencia de toxicidad y efecto antitumoral indirecto probablemente al aumentar la respuesta del huésped.
Palabras clave: C57BL/6J, melanoma B16F10, IFNa, Lymphomyosot, «in vitro», «in vivo».
SUMMARY
Introduction: Several cytokines are being tested in the treatment of melanoma. Among them IFNa should be highlighted, whilst no other experimental studies using homeopathic products are underway. Material & Methods: «In vitro»: the cell line B16F10 was treated at 24, 48 and 72 hours with IFNa/10 at 1,000,000 IU/ml and with Lymphomyosot 1/1 and 1/3 (v/v). Cell viability was quantified using MTT test. «In vivo»: two experiments were carried out on 80 male mice which were injected with 1x105 B16F10 cells and treated with: I (PBS), II (IFNa), III (Lymphomyosot) and IV (IFNa plus Lymphomyosot). A morphological study was also performed. Results: «In vitro»: at high concentrations of IFNa, cell growth was inhibited and Lymphomyosot showed no cytotoxic effects. «In vivo»: IFNa reduced the cell-proliferation rate as well as the extent of spread of inflammatory infiltrates, whilst Lymphomyosot caused a significant tumor weight drop and necrosis. Conclusion: IFNa displayed cytotoxicity in both models whilst Lymphomyosot had an absence of toxicity and an indirect anti-tumor effect, probably due to an increase in the host's response.
Key words: C57BL/6J, melanoma B16F10, IFNa, Lymphomyosot, «in vitro», «in vivo».
INTRODUCCIÓN
Los estudios epidemiológicos señalan un aumento progresivo de las tasas de incidencia y mortalidad del melanoma cutáneo en la mayoría de los países del mundo (1), que en la década pasada fueron mayores que las de ningún otro cáncer (2), siendo responsable del 78% de las muertes por cáncer de piel (3). En los Estados Unidos de América el crecimiento fue del 3,3% anual durante el período 1990-1996 (4). En España (5) se produjeron 639 fallecimientos por melanoma cutáneo en 1995, que supone el 0,7% de las muertes por cáncer en ese año, habiéndose multiplicado la tasa de mortalidad por 3,3 en varones y 2,5 en mujeres durante los últimos veinte años.
Aunque la cirugía suele ser curativa en las etapas precoces, frecuentemente el diagnóstico se realiza en fases evolucionadas donde suele ser ineficaz, lo que explica que se hayan realizado numerosos ensayos con diversas terapias, aunque con efectos escasos y controvertidos (6), además de importantes acciones indeseables. Esto ha llevado al desarrollo de la investigación «in vitro» e «in vivo» sobre todo con antineoplásicos de amplio espectro (7), antibióticos, bioterapia, bioquimioterapia y productos naturales como compuestos fenólicos, citoquinas etc. Durante los últimos años se han ensayado distintas citoquinas entre las que destaca el interferón alfa (IFNa). En 1968 la Food Drug Administration (FDA) aprobó su uso terapéutico que ha demostrado gran eficacia en procesos hematológicos (leucemias, linfomas, mieloma, etc., con remisiones del 75-90%); infecciones virales (hepatitis B y C, herpes y papiloma genital con remisiones entre el 30-70%) e incluso en tumores sólidos (melanoma, carcinoma renal, sarcoma de Kaposi, etc.), aunque con resultados más variables (8).
Por otra parte, las Medicinas Complementarias y Alternativas están creciendo entre la población y su utilización en pacientes con cáncer, no es excepción, pues en distintos países es una práctica frecuente (9) en todo tipo de tumores y estadios de evolución (10). El Lymphomyosot es un agente homeopático que actúa como drenador linfático (11) y activando el mesénquima (base de la inmunorregulación general e inespecífica) (12).
El objetivo de nuestro trabajo ha consistido en estudiar los efectos del IFNa y del producto homeopático Lymphomyosot (individualizados y en combinación) sobre el crecimiento del melanoma B16F10 «in vitro» e «in vivo» trasplantado a ratones C57BL/6J.
MATERIAL Y MÉTODOS
Línea celular: Hemos utilizado la línea murina B16F10, variante altamente metastásica establecida a partir de la línea original B16, procedente de la European Collection Cell Culture (ECCC), U.K. Las células fueron cultivadas en medio mínimo esencial de Eagle pH= 7,2-7,4 (EMEM) de Gibco (EEUU), suplementado con un 10% de suero bovino fetal (SBF) de Gibco, penicilina (100UI/ml) y estreptomicina (100µg/ml) de Sigma Co. (Madrid, España). La incubación se realizó a 37ºC, una atmósfera del 95% de humedad relativa y 5% de CO2.
Animales de experimentación: Utilizamos 80 ratones machos de la cepa C57BL/6J de 11 semanas, procedentes del Servicio de Animales de Laboratorio de la Universidad de Murcia (Licencia 30030-2AB).
Agentes farmacológico y homeopático: Interferón alfa (IFNa) (Roche Farma, Madrid, España), viales inyectables con 18 millones de unidades internacionales (UI) de IFNa en 3 mililitros de solución salina tamponada con fosfato (PBS) de Sigma Co. Lymphomyosot (Biologische Heilmittel Heel GMBH, Baden-Baden, Alemania); producto homeopático compuesto de Myosotis arvensis D3, Verónica D3, Teucrium scorodonia D3, Pinus silvestris D4, Gentiana lutea D5, Equisetum hiemale D4, Zarzaparrilla D6, Scrophularia nodosa D3, Juglans regia D3, Calcium phosphoricum D12 Natrium sulfuricum D4, Fumaria oficinalis D4, Levothyroxinum D12, Aranea diadema D6 0,50 ml, Geranium robertianum D4, Nasturtium aquaticum D4 y Ferrum iodatum D12 ana 1,1 µl.
Procedimiento experimental
Modelo in vitro: Para evaluar el efecto de los agentes sobre el crecimiento celular, sembramos placas de 96 pocillos/1.500 células por pocillo. Después de 24 horas las células fueron incubadas durante 24, 48 y 72 h. con los agentes y a las concentraciones siguientes.
Interferón alfa: 10 UI/ml, 100 UI/ml, 1000 UI/ml, 10.000 UI/ml, 150.000 UI/ml, 200.000 UI/ml, 250.000 UI/ml, 500.000 UI/ml y 1.000.000 UI/ml.
Lymphomyosot: Dos diluciones en el medio de cultivo, (v/v): 1/1 y 1/3.
Cuantificación de la viabilidad celular: Test con MTT.
Para cuantificar la viabilidad celular de los cultivos controles y tratados realizamos el ensayo colorimétrico con MTT adaptando los métodos de Carmichael (13,14) y Alley (15) a nuestras condiciones basándonos en estudios previos (16,17). Cada 24 horas se procedió a la evaluación de la viabilidad celular mediante la incubación durante 4 horas con una dilución de MTT [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide)] (1 mg/ml), posterior solubilización con dimetilsulfóxido y lectura a 570 nm 690 nm de referencia.
Modelo in vivo: Hemos realizado dos experimentos (A y B) con 40 ratones C57BL/6J. En cada experimento distribuimos los animales en cuatro grupos de tratamiento (I, II, III y IV), de 10 animales a los que inoculamos 1x105 células de la línea B16F10 vía subcutánea, en la región inguinal izquierda e iniciamos el tratamiento el mismo día del implante mediante inyección subcutánea en la región inguinal derecha.
Grupo I (Control): PBS (0,2 ml/ratón/5 días por semana).
Grupo II: IFNa (25.000 UI/ratón/3 días por semana. (Dosis total 375.000 UI).
Grupo III: Lymphomyosot (0,2 ml/ratón/5 días a la semana (Dosis total 4,4ml).
Grupo IV: IFNa (3 días a la semana, 375000 UI) + Lymphomyosot (5 días a la semana, 4,4 ml).
Estudio anatomopatológico: A los treinta días de la inoculación tumoral, sacrificamos los animales realizándoles la necropsia. Los tumores fueron pesados y fotografiados, fijados en formol neutro tamponado al 10% y procesados por el método habitual de inclusión en parafina y seccionados a 3 µm. En las secciones teñidas con Hematoxilina-Eosina estudiamos las características microscópicas, arquitectura, citología, etc. así como la extensión de la necrosis tumoral y de los infiltrados inflamatorios, que fueron valorados de 1 a 3 según ocuparan menos de 1/3, 2/3 o más de 2/3 del parénquima tumoral en 10 campos de gran aumento (500X) en cada tumor, por dos observadores.
Estudio Inmunohistoquímico: Lo realizamos en el experimento B. Para la identificación de las células reactivas al antígeno anti-Ki67, se empleó la técnica inmunohistoquimica de estreptavidina-biotina (Dako, Denmark), usando como anticuerpo primario el anticuerpo monoclonal Monoclonal Mouse Anti-Human Ki-67 Antigen Clone MIB.1 (Dako, Denmark) a dilución 1:200. Las muestras se incubaron en cámara húmeda durante 24 horas a 4º centígrados. El revelado se realizó con una solución tamponada conteniendo diaminobencidina (Dako, Denmark). La reacción de oxidación de la peroxidasa fue interrumpida bajo control microscópico mediante el lavado de las preparaciones con agua corriente. El contraste se efectuó con hematoxilina. Para verificar la especificidad de la reacción, el suero anti-Ki67 fue sustituido por PBS en lugar del anticuerpo primario con una muestra control. Para la cuantificación se midió en 10 campos de gran aumento (500x) el número de núcleos positivos en cada tumor.
Estudio estadístico: Para analizar la efectividad de los tratamientos hemos realizado la comparación de medias mediante un análisis de varianza simple o de una vía (tratamiento) controlando la duración de los tratamientos, completando con la comparación de medias dos a dos con el test de la t de Student y la corrección de Bonferroni.
RESULTADOS
I. Modelo «in vitro»
1. Tratamiento con Interferón alfa: Las dosis más bajas (10.000, 50.000 y 100.000 UI/ml) no originaban efectos citotóxicos, mientras que a partir de 150.000 UI/ml comenzaba a observarse una clara respuesta respecto al control, tanto a las 24 horas como a las 48 y 72 horas, existiendo mayor respuesta a las dosis superiores, de modo que ocurría una inhibición del 100% del crecimiento celular con las dosis de 1.000.000UI/ml (gráficas 1 y 2).
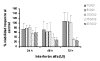
Gráfica 1:
Tratamiento con Interferón
a
desde 10.000 hasta 200.000 UI durante 24, 48 y 72 horas.
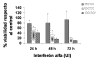
Gráfica 2:
Tratamiento con Interferón
a
desde 250.000 hasta 1.000 000 UI durante 24, 48 y 72 horas.
2. Tratamiento con Lymphomyosot: Tras la exposición al agente homeopático Lymphomyosot no observamos efectos citotóxicos a ninguna de las dosis utilizadas (50 µl y 100 µl), de modo que la evolución en el tiempo de los cultivos tratados fue similar a la de los controles y aunque existía diferencia de la absorbancia a lo largo del tiempo (P< 0,00001) no observamos diferencias significativas entre las distintas dosis. La diferencia de tiempos se mantenía en las dos concentraciones, es decir, evolucionaban del mismo modo que el control, de forma que el número de células iba aumentando significativamente a lo largo del tiempo. El porcentaje de células vivas respecto de los controles fue prácticamente del 100% (gráfica 3).
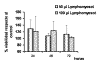
Gráfica 3:
Tratamiento con Lymphomyosot a 50 y 100 µl durante 24, 48 y 72 horas.
Estudio microscópico: Al microscopio de contraste de fases observamos tras el tratamiento con IFNa la presencia de abundantes restos celulares, así como disminución de la densidad celular respecto a los controles. Ocasionalmente se apreciaba vacuolización perinuclear y retracción de los citoplasmas celulares, con aumento de las prolongaciones dendríticas que presentaban ramificaciones frecuentes. Con las mayores concentraciones, aparecían restos adheridos al fondo sin halo refringente periférico, así como restos celulares de pequeño tamaño, birrefringentes y esféricos. También aparecían algunas células vivas de morfología esférica, refringentes y con una gran vacuola excéntrica y el núcleo desplazado. Tras el tratamiento con Lymphomyosot, las células no mostraban alteraciones relevantes respecto a los controles.
II. Modelo «in vivo»
En los dos experimentos realizados (A y B) las células tumorales prendieron en todos los animales inoculados; de modo que eran palpables a los 4-6 días del implante como pequeñas masas redondeadas en la región inguinal izquierda y visibles al final de la primera semana post-implante. En el estudio macroscópico los tumores presentaban morfología redondeada u ovoide de superficie multinodular irregular, consistencia blanda, y a la sección mostraban aspecto friable con coloración negra similar a la de la superficie y áreas amarillentas de aspecto necrótico. Estaban bien delimitados por una fina cápsula de aspecto conjuntivo, que en múltiples zonas, se encontraba infiltrada por el tumor. Las células tumorales se extendían infiltrando las estructuras adyacentes: músculo, piel, etc. de las que eran difícil de separar.
En el estudio microscópico óptico el parénquima tumoral, en todos los tumores, estaba constituido por pequeños grupos de melanocitos, dispuestos de forma compacta y delimitada por un fino entramado reticulínico con numerosos capilares sanguíneos entre los grupos celulares. Los melanocitos mostraban morfología redondeada o poligonal con moderado pleomorfismo y núcleos voluminosos que con frecuencia eran dobles con nucléolos prominentes y eosinófilos. Los citoplasmas eran en general, amplios y ligeramente eosinófilos, con abundante pigmento melánico.
Experimento A
1. PESOS TUMORALES: Los pesos de los tumores eran mayores en el grupo control (I) en el que oscilaban entre 8 y 10,8 g, media de 9,72 g seguidos por los del grupo del tratamiento combinado (IV) que oscilaban entre 9 g y 9,4 g, media de 9,08g y por los grupos (II) IFNa entre 3,6 y 12 g, con una media de 8,08 g y (III) Lymphomyosot entre 4,65 g y 8,2 g, media de 6,25 g (tabla I) (fig. 1).
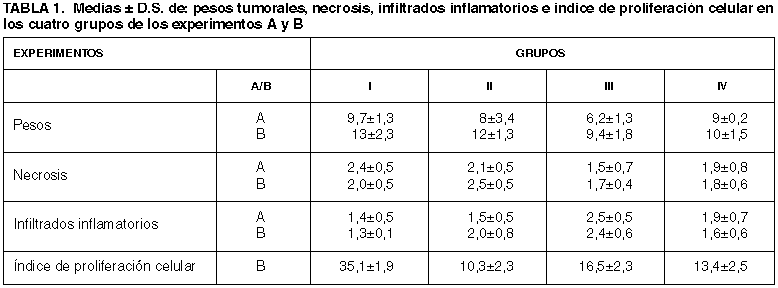
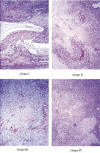
Fig.1:
Características microscópicas del parénquima tumoral, áreas de necrosis e
infiltrados inflamatorios en los cuatro grupos del experimento A. H.E. 125x.
El análisis estadístico demostró diferencias entre los pesos de los tumores del grupo Control (I) y los del grupo tratado con Lymphomyosot (III) que eran significativamente menores (P<0,007), así como entre los de este grupo (III) Lymphomyosot y el del tratamiento Combinado (IV) (P<0,008). No existiendo diferencias significativas entre los demás grupos.
2. NECROSIS TUMORAL: La necrosis tumoral se disponía en áreas irregulares, predominando en las zonas centrales, con infiltrados de polimorfonucleares neutrófilos y linfocitos en las zonas periféricas, siendo de mayor extensión significativamente en el grupo Control (I) respecto al tratado con Lymphomyosot (III) (P<0,0055) (fig. 1). Asimismo, existían diferencias aunque no significativas entre el grupo (I) Control y el del tratamiento Combinado (IV). También existía una tendencia mayor, aunque no significativa respecto a la necrosis, entre el grupo (II) tratado con IFNa y el tratado con Lymphomyosot (III).
3. INFILTRADOS INFLAMATORIOS: En el análisis de los infiltrados observamos que existían diferencias significativas entre el grupo Control (I) y el del tratamiento con Lymphomyosot (III) (P<0,0002) así como entre el tratado con IFNa (II) y el grupo tratado con Lymphomyosot (III) (P<0,0005) (fig. 1). También existían diferencias significativas entre el grupo tratado con Lymphomyosot (III) y el Combinado (IV) (P<0,03), siendo mayores los infiltrados inflamatorios en el grupo del Lymphomyosot (III). Asimismo observamos una tendencia menor aunque no era significativa entre la extensión de los infiltrados inflamatorios del grupo Control (I) y la del tratamiento Combinado (IV).
Ante estos resultados tan sorprendentes, ya que la mayor reducción de los pesos tumorales correspondió a los tratados con Lymphomyosot, repetimos el experimento en similares condiciones (40 ratones C57BL/6J, adultos de 11 semanas y 1x105 células tumorales inoculadas) en el que realizamos además el análisis del índice de proliferación celular, mediante el estudio inmunohistoquímico con el marcador anti-Ki 67.
Experimento B
Los pesos de los tumores en este segundo experimento oscilaban entre 10,2 g y 15,7 g, con una media de 13,45 g en el grupo Control (I); entre 11,2 g y 14,7 g, media 12,7 g en el grupo del IFNa (II); entre 7,3 g y 10,7 g, media 9,46 g en el grupo de Lymphomyosot (III) y entre 8,4 g y 12,45 g, media de 10,49 en el grupo Combinado (IV) (tabla 1). Asimismo al realizar el análisis estadístico observamos que existían diferencias significativas entre los pesos tumorales del grupo Control (I), que eran mayores, que los de los grupos tratados con lymphomyosot (III) (P<0,01) y Combinado (IV) (P<0,02). También existían diferencias significativas entre los tumores del grupo tratado con IFNa (II) y los del tratado con Lymphomyosot (III) siendo menores en este grupo (P<0,01). Asimismo, existían diferencias significativas entre los tumores del grupo (III) Lymphomyosot y Combinado (IV) (P<0,02), siendo mayores en este último grupo.
Respecto a necrosis tumoral en el experimento B, encontramos diferencias significativas en cuanto a su extensión en el grupo tratado con IFNa, (II) que era mayor que en el tratado con Lymphomyosot (III) (P<0,004) y (IV) Combinado (P<0,01). También se apreciaba una tendencia aunque no significativa entre la necrosis de los grupos (I) Control, Lymphomyosot (III) y (IV) Combinado.
En cuanto a la extensión de los infiltrados inflamatorios, eran menores en los grupos (I) Control y el del tratamiento (IV) Combinado respecto a los demás grupos, siendo las diferencias significativas entre el grupo (I) Control respecto a las del grupo tratado con Lymphomyosot (III) (P<0,001), así como entre el grupo de tratamiento Combinado (IV) respecto al tratado con Lymphomyosot (III) (P<0,02).
El estudio inmunohistoquímico realizado en este grupo con el marcador de proliferación celular anti-Ki67 (fig. 2) demostró la existencia de un índice de proliferación celular mayor en el grupo Control (I) (media de 35,180) que mostraba diferencias significativas respecto a los de los grupos tratados con IFNa (II) (10,273) (P<0,0001), grupo (III) Lymphomyosot (16,440) (P<0,0001) y (IV) Combinado (13,420) (P<0,0001). Asimismo el índice de proliferación celular era menor significativamente en el grupo (II) tratado con IFNa respecto a los de los grupos (III) tratado con Lymphomyosot (P<0,0001) y (IV) Combinado (P<0,0001). También era menor en el grupo (IV) del tratamiento Combinado respecto al tratado con Lymphomyosot (III) aunque sin diferencias significativas.

Fig. 2:
Estudio inmunohistoquímico con el marcador de proliferación celular (anti-Ki67)
en los cuatro grupos del experimento B. 125x.
DISCUSIÓN
Actualmente, uno de los grandes retos de la oncología corresponde al tratamiento del melanoma, pues aunque el tratamiento quirúrgico suele ser curativo en sus etapas precoces, como con frecuencia el diagnóstico se realiza en fases evolucionadas, en las que la cirugía no suele ser eficaz, se explica el que se haya ensayado la administración de numerosos agentes, aunque con pobres tasas de respuesta e importantes efectos indeseables. Por otra parte las Medicinas Complementarias y Alternativas (CAM), también denominadas Medicinas Integrales, que incluyen una amplia gama de filosofías, acercamientos y modalidades terapéuticas, entre las que se encuentra la homeopatía, suelen utilizarse junto con los tratamientos convencionales o bien como su alternativa en un intento de disminuir los síntomas o los efectos secundarios, fundamentalmente los de la radioterapia y la quimioterapia e incluso a veces en un intento de curar la enfermedad (18).
En nuestro estudio «in vitro» la línea B16F10 mostró diferente sensibilidad a los dos agentes ensayados, siendo muy sensible al IFNa. Lo que confirma los estudios de Jezersek (19) sobre la inhibición del crecimiento del melanoma B16 con el tratamiento con IFNa individualizado así como combinado con vinblastina y otros agentes. También, los estudios de Horikoshi (20) con los tres tipos de interferón a, b y g sobre células de la línea de melanoma humano SK-MEL demostraron efectos dosis-tiempo-dependiente, aunque se observó mayor efecto con el IFN b Más recientemente Maellaro (21) demostró que el IFNa originaba inhibición de la proliferación celular en cinco líneas de melanoma aunque sólo en dos de ellas (HT-144 y Me665/2/21) indujo apoptosis. Asimismo, con la línea celular K562 de leucemia mieloide crónica, se ha observado que el ciclo celular era detenido en la fase S con la consecuente acumulación en la fase G1, sin inducir apoptosis (22).
En nuestro estudio tuvimos que adaptar el modo de utilización del Lymphomyosot a nuestro modelo «in vitro» teniendo en cuenta las dosis utilizadas de este compuesto en clínica (una ampolla de 1,1 ml diaria i.m., s.c, i.v., i.d., oral por paciente y día). Para ello debimos ajustar las dosis utilizadas al volumen de medio de cultivo y a la capacidad del recipiente donde se cultivaban las células, entendiendo que la exposición directa de las células al compuesto sería mayor a las utilizadas «in vivo», con lo que podríamos evaluar con mayor exactitud cualquier alteración en el crecimiento celular. Nuestro trabajo ha demostrado ausencia de acción tóxica sobre la viabilidad y el crecimiento de las células tumorales con todas las dosis ensayadas.
En cuanto al modelo «in vivo», en el primer experimento (A) destacaba que los pesos de los tumores del grupo tratado con Lymphomyosot eran significativamente menores que los del grupo Control y Combinado, mientras que los pesos del grupo tratado con IFNa, aunque también eran menores, no mostraban diferencias significativas respecto a los demás grupos, por otra parte la extensión de la necrosis tumoral era mayor en los grupos Control e IFNa respecto de los grupos del Lymphomyosot y Combinado, aunque solo el Lymphomyosot mostró diferencias significativas al Control. Del mismo modo, la extensión de los infiltrados inflamatorios, era mayor en los grupos tratados con Lymphomyosot y Combinado respecto a los otros dos grupos, mostrando el Lymphomyosot diferencias significativas respecto al Control, lo que parece demostrar la acción estimulante del Lymphomyosot sobre el sistema inmune ejerciendo probablemente una acción inmunomoduladora en el grupo de tratamiento Combinado, apoyando la acción del IFNa.
Estos sorprendentes resultados, consideramos que, de una parte confirman el efecto antitumoral reconocido para el IFNa; ya que en los numerosos estudios clínicos sobre los efectos de las citoquinas en el tratamiento del melanoma, parecen demostrar altas tasas de respuesta e incluso remisiones prolongadas en algunos pacientes (7), entre las que destaca el IFNa que ha mostrado acción antitumoral, pero con un amplio rango de actividades biológicas, por lo que la dosis óptima y sus efectos pueden variar ampliamente. En un meta análisis con 3000 pacientes (23) no observaron relación dosis-respuesta aunque si una elevada relación dosis-toxicidad, confirmando lo observado previamente por Russell-Jones (24), en la que el IFNa, a dosis bajas mostraba efectos beneficiosos con alargamiento de la supervivencia libre de enfermedad, mientras que con dosis altas primaban los efectos tóxicos, de modo similar en el estudio randomizado de 4000 pacientes de Hancock (25).
Por otra parte, nuestro estudio demuestra la misma acción antitumoral para el agente homeopático Lymphomyosot, acción que no había sido descrita hasta ahora y que creemos que puede estar relacionada con un mecanismo indirecto al estimular al sistema inmune o bien impidiendo el desarrollo tumoral al afectar al estroma.
Ante estos resultados sorprendentes realizamos un segundo experimento (B), con similares condiciones, en el que los pesos tumorales menores correspondían de nuevo a los tumores del grupo tratado con Lymphomyosot que mostraba diferencias significativas respecto a los demás grupos. También en el grupo Combinado, aunque no existían diferencias significativas, los pesos también eran menores que los de los grupos Control y de tratamiento con IFNa. Asimismo, la extensión de la necrosis tumoral era significativamente mayor en el grupo tratado con IFNa que en los grupos tratados con Lymphomyosot, Combinado y Control. Estos datos corroboran el efecto citotóxico del IFNa, y la ausencia de citotoxicidad del Lymphomyosot. Del mismo modo observamos que los infiltrados inflamatorios eran significativamente de mayor extensión en el grupo tratado con Lymphomyosot que en los grupos Control y el Combinado, mientras que en el grupo tratado con IFNa se asemejaban al del Lymphomyosot, lo que creemos que indican una vez más la posible acción imnunoestimulante de este. Respecto al índice de proliferación celular, observamos que era menor significativamente en el grupo tratado con IFNa respecto al del Lymphomyosot, combinado y Control, apoyando asimismo la acción citotóxica del IFNa.
En los dos experimentos los pesos tumorales eran significativamente menores en el grupo tratado con Lymphomyosot, seguido de los del IFNa y combinado respectivamente. Lo que demuestra el efecto antitumoral de ambos agentes estudiados. No obstante la necrosis tumoral, era mayor y el índice de proliferación menor que en los tratados IFN_, lo que apoya el efecto citotóxico y antitumoral del IFNa, mientras que la extensión de los infiltrados inflamatorios era mayor en los tumores tratados con Lymphomyosot y Combinado. Consideramos que indica la posible acción estimuladora del sistema inmune por el Lymphomyosot.
CONCLUSIÓN
Ambos agentes han demostrado en nuestro estudio efecto antitumoral directo citotóxico en el IFNa (en ambos modelos) e indirecto por posible inmunoestimulación en el Lymphomyosot.
AGRADECIMIENTOS
A D. Victor Bolarín, Técnico en Anatomía Patológica por su asistencia técnica, y a D.ª Carmen Lagares y D. Antonio Cano del Servicio de Animales de Laboratorio (SACE) de la Universidad de Murcia. Este trabajo ha sido parcialmente financiado con una ayuda del Plan Nacional de I+D (nº PETRI 1995-0582).
BIBLIOGRAFÍA
Marks, R. Epidemiology of melanoma. Clin Exp Dermatol 2001; 25: 459-63.
Lucci A, Citro HW, Wilson L. Assessment of knowledge of melanoma risk factors, prevention, and detection principles in Texas teenagers. J Surg Res 2001; 97: 179-83.
Horn-Ross, PL. Melanoma in the Greater San Francisco Bay Area 1988-2000. Northern California Cancer Center (serial online) (citado marzo 2003). Disponible en: URL: http://www.nccc.org/pdf/poc/melanoma_factsheet _88-2000.pdf
Linet MS. Evolution of cancer epidemiology. Epidemiol Rev 2000; 22: 35-56.
Ministerio de Sanidad y Consumo. Epidemiología y prevención del cáncer en España. Cáncer de piel. Melanoma maligno cutáneo 2001. Disponible en: URL: http:/www.msc.es/salud/epidemiologia/cancer/epidemioprevenvión/melanoma/piel.htm
Mohr P, Weishentahl M, Hauschild A . Adjuvant Therapy in Melanoma. Onkologie 2003; 26: 227-33.
Hansson J. Systemic Therapy of malignant melanoma. Med Oncol 1997; 14: 73-81.
Blank V, Roguin L. El interferón alfa: una proteína de uso terapéutico. Ciencia hoy 2003; 12(72): 20-31.
Schraub S. Unproven Methods in cancer: a worldwide problem. Support Cancer Care 2000; 8, 10-5.
Richardson MA, Straus SE. Complementary and alternative medicine: Opportunities and challenges for cancer management and research. Semin Oncol 2002; 29: 531-45.
Borner M, Zenner S. Terapia de detoxicación con medicamentos homeopáticos compuestos. Resultado de un estudio de aplicación multicéntrico. Medicina Biológica 1996; 2: 240.
Ricken KH. Lymphomyosot: eslabón entre el mesénquima y el sistema linfático. Medicina Biológica 1993; 2.
Carmichael J, DeGraff WG, Gazdar AF, Minna JD, Mitchell JB. Evaluation of a tetrazolium-based semiautomated colorimetric assay: assessment of chemosensitivity testing. Cancer Res 1987 a; 47: 936-42.
Carmichael J, DeGraff WG, Gazdar AF, Minna JD, Mitchell JB. Evaluation of a tetrazolium-based semiautomated colorimetric assay: assessment of radiosensitivity. Cancer Res 1987 b; 47: 943-6.
Alley MC, Scudiero DA, Monks A, Hursey ML, Czerwinski MJ et al. Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay. Cancer Res 1988; 48: 589-601.
Rodríguez-Vicente J, Vicente-Ortega V y Canteras-Jordana M. Valor del ensayo colorimétrico con MTT en el estudio del crecimiento y citotoxicidad in vitro de líneas de melanoma. Patología 1997; 30: 18-27.
Yánez J, Vicente V, Alcaraz M, Castillo J, Benavente- García O, Canteras M et al. Cytotoxicity and antiproliferative activities of several phenolic compounds against three melanocytes cell lines: relationship between structure and activity. Nutr Cancer 2004; 49: 191–9.
Monfort H. A new homeopathic approach to neoplasic diseases: from cell destruction to carcinogen-induced apoptosis. Br Homeopath J 2000; 89:78-83.
Jezersek B, Novakovic S, Sersa G, Auersperg M, Fleischmann WR Jr. Interactions of interferon and vinblastine on experimental tumor model melanoma B-16 in vitro. Anticancer Drugs 1994; 5: 53-6.
Horikoshi T, Fukuzawa K, Hanada N, Ezoe K, Eguchi H, Hamaoka S, Tsujiya H, Tsukamoto T. In vitro comparative study of the antitumor effects of human interferon-alpha, beta and gamma on the growth and invasive potential of human melanoma cells. J Dermatol 1995; 22: 631-6.
Maellaro E, Pacenti L, Del Bello B, Valentini MA, Mangiavacchi P, De Felice C et al. Different effects of interferon-alpha on melanoma cell lines: a study on telomerase reverse transcriptase, telomerase activity and apoptosis. Br J Dermatol 2003; 148: 1115-24.
Grebenova D, Kuzelova K, Fuchs O, Halada P, Havlicek V, Marinov I et al. Interferon-alpha suppresses proliferation of chronic myelogenous leukemia cells K562 by extending cell cycle S-phase without inducing apoptosis. Blood Cells Mol Dis 2004; 32: 262-9.
Eggermont AM, Kleeberg UR, Ruiter DJ, Suciu S. The European Organization for Research and Treatment of Cancer Melanoma Group Trial experience with more that 2000 patients, evaluating adjuvant therapy treatment with low or intermediate doses of interferon alpha-2b. Am Soc Clin Oncol 2001 Educational Book. Alexandria, Virginia, 2001; 88-93.
Russell-Jones R. Interferon-alpha therapy for melanoma. Med Oncol 2000; 25: 1-6.
Hancock BW, Harris S, Wheatley K, Gore M. Adjuvant interferon-alpha in malignant melanoma: current status. Cancer Treat Rev 2000; 26: 81-9.