
Vol. 38, n.º 4, 2005
REVISTA
ESPAÑOLA DE
Vol. 38, n.º 4, 2005 |
REVISIONES
Marcial García Rojo, Gloria Bueno García1, Carlos Peces Mateos2, Jesús González García, Manuel Carbajo Vicente
Servicio de Anatomía Patológica. Complejo
Hospitalario de Ciudad Real.
1 ETS Ingenieros Industriales. Universidad de Castilla La Mancha.
Ciudad Real.
2 Área de Tecnologías de la Información. SESCAM. Toledo.
RESUMEN
Introducción: Las soluciones tecnológicas para la realización de preparaciones digitales son muy diversas y se pueden clasificar en dos grandes grupos: microscopios robotizados y escáneres. Comparación entre sistemas: En este artículo, se comentan los aspectos técnicos que ofrecen 28 sistemas de microscopía digital (microscopios robotizados o escáneres) disponibles en el mercado. Se describen las características más relevantes de los dispositivos de escaneado, las cámaras empleadas, la velocidad y calidad de las imágenes, los tipos de ficheros y compresión y las soluciones de visualización de preparaciones digitales, incluyendo herramientas de ayuda al diagnóstico. Conclusiones: La mayoría de las soluciones permiten digitalizar una preparación completa, con un objetivo 40x y con la calidad máxima en, aproximadamente, una hora. La calidad de imagen que ofrecen los sistemas actuales es adecuada para fines asistenciales, docentes y de investigación.
Palabras clave: microscopía virtual, preparaciones digitales, microscopio robotizado, escáner.
SUMMARY
Introduction: The technological solutions for whole slide scanning are very diverse and they have been classified into motorized microscopes and scanners. Comparison of existing systems: This article describes technical aspects of 28 different digital microscopy systems. The most relevant characteristics of the scanning devices are described, including the cameras used, the speed of digitization and the image quality. Other aspects, such as the file format, the compression techniques, and the solutions for visualization of digital slides, including diagnosis-aided tools are also taken into consideration. Conclusions: Most of the analyzed systems allow digitizing a complete slide using with a 40x objective, with the best quality available in, approximately, an hour. The image quality of the current virtual microscopy systems is suitable for clinical, educational and research purposes.
Key words: virtual microscopy, whole slide scanning, motorized microscope, scanner.
INTRODUCCIÓN
Los sistemas de microscopía virtual, entendidos como aquellos capaces de digitalizar totalmente las preparaciones histológicas y citológicas o WSI (whole slide imaging, en inglés), están disponibles hoy día en múltiples formatos y soluciones comerciales.
La historia de estos dispositivos es relativamente reciente. En 1997, el Departamento de Ciencias de la Computación de la Universidad de Maryland y el Departamento de Patología de los Hospitales Johns Hopkins (Baltimore, EE.UU.) describieron los primeros sistemas de microscopía virtual (1,2)
Actualmente, es posible digitalizar todo tipo de preparaciones histológicas o citológicas, desde gruesos cortes (15 µm) de tejidos incluidos en parafina, hasta finos cortes de 5 µm de inmunohistoquímica o de inmunofluorescencia (Mirax Zeiss Scan).
En la literatura, no existen revisiones recientes sobre las posibilidades reales de las diversas soluciones de microscopía virtual disponibles. En 2003, la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORTC) publicó los resultados de una encuesta de sistemas de microscopía virtual, con información muy exhaustiva sobre aquellos entonces disponibles (3D Histech, Aperio, Histkom, InterscopeTech, Leica/Van Hopplynus, Olympus, Nikon, Samba, Syncroscopy, Trestlecorp, Zeiss y Zem) (3).
El objetivo de este estudio es describir de forma comparativa las diversas soluciones disponibles para la digitalización completa de preparaciones en Anatomía Patológica, así como otros productos relacionados.
CLASIFICACIÓN DE SISTEMAS DE DIGITALIZACIÓN
Según su objetivo, las soluciones de imagen digital se pueden clasificar en microscopios digitales (escaneado total de la preparación) y en sistemas de ayuda al diagnóstico. Llamamos microscopios digitales o WSI a los dispositivos cuyo objetivo principal es la creación de preparaciones digitales, siendo capaces de digitalizar toda la preparación a gran aumento. Los sistemas de ayuda al diagnóstico son los diseñados para facilitar la localización de área de interés, e incluso cuantificar señales biomédicas; están incluidos en esta revisión aquellos que permiten digitalizar toda la preparación –al menos a bajo aumento– o al menos una región de interés, y no sólo almacenar una única fotografía de un campo microscópico.
Utilizando un criterio basado en los componentes del dispositivo, distinguimos dos grandes grupos: microscopios robotizados y escáneres.
Hemos clasificado dentro del grupo de los microscopios robotizados aquellos que incluyen microscopios que mantienen su funcionalidad y componentes originales, incluyendo oculares, múltiples objetivos (revólver motorizado) y control de la posición y foco. El segundo componente principal de estos sistemas son las cámaras fotográficas acopladas al microscopio. Por último, otro de los componentes esenciales es el software de control del microscopio y de la cámara. Generalmente, el método de escaneado de estas soluciones es el escaneado progresivo (fotograma a fotograma).
Por otro lado, los escáneres de preparaciones incluyen componentes similares a los microscopios robotizados, pero han sufrido diversas modificaciones (ausencia de oculares y de control de posición o de foco) que los convierten en dispositivos específicos para microscopia virtual. Son sistemas cerrados, a la que sólo se accede para añadir las bandejas de preparaciones que han de ser escaneadas. Los escáneres son controlados por un ordenador, a menudo situado en interior de la caja del escáner. Además, suelen incorporar un mecanismo antivibración. En la tabla I se indican la clasificación de estos dispositivos de microscopía digital.

COMPONENTES DE LOS SISTEMAS DE DIGITALIZACIÓN COMPLETA DE PREPARACIONES
Todos los dispositivos de microscopía virtual de alta resolución se componen, esquemáticamente, de un sistema de microscopía óptica, un sistema de captura (fotografía), un software de control del proceso de escaneado y un visor de preparaciones digitales. Además, existen otros componentes opcionales, como alimentador de preparaciones o un programa de análisis de imagen.
Cámaras Fotográficas
La cámara fotográfica con la que se toman las imágenes es uno de los factores críticos en la calidad y velocidad de la solución de microscopía digital, por ello es necesario conocer sus características.
Generalmente se trata de cámaras con un sensor CCD (charged coupled device), el cual genera una señal analógica. En las cámaras digitales la conversión analógica-digital se produce dentro de la cámara. Las características de calidad de una cámara digital vienen determinada, principalmente, por la resolución de imagen o tamaño del CCD (número de píxeles que el sensor CCD es capaz de detectar) (tabla II).
La mayoría de las cámaras digitales se conectan al ordenador a través de un puerto «Firewire» (LifeSpan Alias, Olympus SIS .Slide, Zeiss Mirax Scan), por lo que no es necesario utilizar tarjetas capturadoras. Clarient ACIS utiliza la capturadora Matrox Meteor-II/multi-canal. Hamamatsu C9600 NanoZoomer y Aperio ScanScope T2 y T3 utilizan una conexión CameraLink.
En cuanto al adaptador entre cámara y microscopio, la lente correctora es de 1.0x (LifeSpan Alias, Olympus SIS .Slide, Zeiss Mirax Scan) o 0,63x (Zeiss Mirax Scan, Samba Naviqap). Algunos sistemas utilizan rosca F (LifeSpan Alias, Aperio ScanScope).
Platinas
Las platinas de excelente precisión y alta velocidad empleadas en las soluciones de microscopía virtual, permiten alcanzar velocidad de movimiento de 32 mm/s (Zeiss Mirax Scan), 38 mms/s (Aperio ScanScope T2 y T3), 41,22 (LifeSpan Alias) o, incluso, hasta 180 mm/s (Olympus SIS .slide). La precisión de estas platinas es de 1 a 3 micrómetros, aunque algunos dispositivos (Syncroscopy Synchroscan y Montage Explorer, LifeSpan Alias, Bacus BLISS, Olympus SIS .Slide), consiguen precisiones o distancias mínimas de 0,002 a 0,015 micras para el eje Z, y 0,25 micras en los ejes X e Y.
Los modelos de platinas utilizadas son: Daedal 106004 (Aperio ScanScope T2 y T3), Leica CTR MIC (LifeSpan Alias), Maerzhauser scan 100*80 (Olympus SIS .Slide).
En los microscopios robotizados, la platina puede ser controlada mediante joystick (Olympus SIS .Slide) o Leica SmartMove (LifeSpan Alias).
Iluminación
El método más frecuente es la utilización de una lámpara halógena (100 w en Olympus SIS .slide) y en los escáneres puede ser de fuente interna (EKE 150 w, Aperio ScanScope T2) o externa (EKE 150 w, Aperio ScanScope T3).
Existen sistemas que emplean iluminación por LEDs, ya sea blanco (Nikon Coolscope) o LED multiespectral (LifeSpan Alias).
Zeiss Mirax Scan incorpora luz blanca de alto brillo con filtro complementario de temperatura de color; además, permite utilizar campo oscuro o fluorescencia. Esta última opción, junto con polarización, también están disponibles en Olympus SIS .slide.
Hardware
En cuanto al equipo informático, la mayoría de las soluciones actuales están basados en estaciones de trabajo con dos microprocesadores Xeon (2,8 GHz a 3,6 GHz) y 4 GB de memoria RAM. El sistema operativo empleado por los dispositivos de control y las estaciones de trabajo es, generalmente, Windows XP Professional.
Aunque recomendamos una gestión centralizada del almacenamiento a través de los servidores del centro hospitalario, en caso de ser necesario disponer de un almacenamiento propio, algunos fabricantes aconsejan la siguiente configuración: 6 discos, cada uno de 300 GB, 10k rpm hot swap (un total de 3,8 terabytes).
Monitores de alta resolución
Todos las soluciones de microscopía virtual incorporan monitores de gran formato, generalmente planos (TFT), de 20" a 23". Estos monitores deben ser de alta resolución, como el IBM T221, un monitor LCD TFT de 9 millones de píxeles (3.840 x 2.400 píxeles), con una resolución de 200 ppp. Con este tamaño, el campo visible es cuatro veces superior al del microscopio convencional. Este monitor de IBM, incluido en los modelos de Zeiss Mirax Scan, tiene una proporción de contraste de 400:1.
Aperio ScanScope se acompaña de monitores HP 2335 LCD de 23" (1.920 x 1.200 píxeles, distancia píxel 0,258 mm, contraste 500:1). Olympus SIS .slide incorpora un monitor NEC LCD2080UX+ de 20,1" (1.600 x 1.200 píxeles, distancia píxel 0,255 mm, contraste 450:1). Bacus BLISS también incorpora un monitor LCD de 20,1".
EL PROCESO DE DIGITALIZACIÓN O ESCANEADO DE PREPARACIONES
En este apartado se describen aspectos a tener en cuenta en el proceso de digitalización, como la velocidad de digitalización, los portaobjetos y tamaño máximo de la muestra, la calidad de enfoque, la digitalización en distintos planos, el método de escaneado y ensamblaje de la zona escaneada y los formatos de almacenaje de las muestras digitalizadas. Los precios de los sistemas de digitalización oscilan entre los 75.000 euros y los 180.000 euros, excepto Nikon Coolscope, de coste significativamente menor, aunque más lento que el resto. La tabla III también incluye algunos aspectos de interés de los sistemas de digitalización más conocidos.
1) Velocidad de digitalización
La velocidad de digitalización o tiempo total de escaneado es uno de los factores más relevantes en la decisión de adquirir estas soluciones. Sin embargo, su evaluación objetiva es muy difícil, pues hay que considerar aspectos como:
El tamaño del área que se desea escanear.
El objetivo empleado (20x o 40x). DMetrix DX-40 es capaz de capturar 3.000 imágenes/s en cada uno de sus 80 objetivos.
El tamaño de CCD de la cámara.
El modelo de platina motorizada empleado.
El tiempo de la fase de previsualización: vista panorámica, selección de área de interés y el método de enfoque.
El número de puntos de enfoque necesarios (las preparaciones de superficie irregular requieren establecer un alto número de puntos de enfoque, lo que disminuye la velocidad de escaneado).
El número de planos (en el eje Z) que se digitalicen.
La velocidad de captura de datos (de cámara a ordenador y de éste al almacenamiento).
En soluciones con cargador de preparaciones, el tiempo de carga de preparación (en Mirax Scan, 3-4 segundos para carga y otro intervalo similar para descarga) y lectura del código de barras. En total, este tiempo es de unos 15 segundos.
Las tablas IV y V recogen los tiempos de escaneado con objetivos 10x y 40x, ordenados ascendentemente, según la información proporcionada por los fabricantes.

2) Portaobjetos y tamaño máximo de la muestra
Todos los dispositivos analizados trabajan con portaobjetos convencionales de 1 x 3 pulgadas (25 x 75 mm) y 1 mm de grosor, pero hemos observado que algunos sistemas, como las primeras versiones de Nikon Coolscope, no funcionan bien con portaobjetos de esquinas redondas, mientras que éstos son los recomendados por Zeiss Mirax Scan.
Según el modelo de platina motorizada utilizada, puede variar la superficie total de la preparación histológica que es posible escanear, así como el tipo de preparaciones. Es frecuente que los escáneres o microscopios robotizados puedan recorrer todo el ancho del cristal (27 mm) pero generalmente sólo recorren un 60-70% de su longitud (50 mm) pues se considera que no es necesario un proceso de digitalización del área correspondiente a la etiqueta, la cual es fotografiada con una cámara específica (Aperio ScanScope, LifeSpan Alias) o trascrita por un lector de código de barras (Zeiss Mirax Scan).
Aperio ScanScope T3 permite trabajar con portaobjetos grandes de 2 x 3 pulgadas. Esta opción también está disponible en Olympus SIS .slide.
El área máxima de escaneado de Aperio ScanScope T2 es de 22,9 mm x 54,9 mm, en Aperio ScanScope T3 es de 26,3 mm x 56,1 mm (50 mm x 57,1 mm en cristales grandes), y en Zeiss Mirax Scan es de 27 mm x 50 mm.
En cuanto al grosor de las preparaciones, convienen tener en cuenta que una preparación histológica o citológica rota, que haya sido reparada añadiendo un segundo porta, puede dificultar o impedir su digitalización en algunos escáneres de preparaciones. Estas preparaciones son fácilmente digitalizables con soluciones basadas en microscopios convencionales robotizados (Bacus BLISS, Olympus SIS .slide), pero no se recomienda su uso en escáneres como Aperio ScanScope.
El mecanismo de sujeción de las preparaciones puede ser por pinza (Bacus BLISS), presión lateral (Olympus SIS .slide) o vacío (LifeSpan Alias).
3) Calidad del enfoque
En la calidad del enfoque podemos evaluar los siguientes parámetros:
El rango del movimiento de foco de un sistema (150 micrómetros en Zeiss Mirax Scan).
Tiempo de ajuste del foco (0,1 s en Zeiss Mirax Scan).
Distancia mínima (least step): (0,15 micrómetros en Zeiss Mirax Scan).
Método de cálculo de distancia: luz láser infrarroja de 780 nm de longitud de onda (Zeiss Mirax Scan) o método de triangulación punto a punto (Aperio ScanScope T2).
Resolución de movimiento del eje Z: 0,3 micrómetros con objetivo 20x en Zeiss Mirax Scan y 0,1 micras en Aperio ScanScope T3 con objetivo 40x.
El número de puntos de foco (mapa de foco) puede ser asignado de forma automática (Aperio ScanScope T2 y T3, Hamamatsu C9600 NanoZoomer); según un algoritmo elegido, de menor a mayor complejidad (Olympus SIS .slide); o de forma manual (Aperio ScanScope T2 y T3, Hamamatsu C9600 NanoZoomer).
En Aperio ScanScope T2 y T3 y Hamamatsu C9600 NanoZoomer es posible añadir manualmente puntos de enfoque a los que se detectan automáticamente. En Olympus SIS .slide los números de puntos de enfoque se asignan automáticamente según el algoritmo de enfoque elegido.
Cuando una zona de la preparación es especialmente difícil de enfocar, los sistemas basados en microscopios robotizados (tabla I) permiten un mayor control de posición de la platina. Sin embargo, los escáneres de Aperio también disponen de un modo de observación directa que permite ajustar manualmente el foco de un punto determinado.
4) Digitalización de múltiples planos del eje Z
Cuando el tejido es grueso o la muestra tiene aspectos tridimensionales que queremos recoger, como sucede en citología, es necesario que el sistema de escaneado sea capaz de digitalizar múltiples planos de enfoque (en el eje Z), de forma que el patólogo, posteriormente podrá visualizar esos múltiples planos recorriéndolos de arriba abajo, igual que hace al manejar el micro-métrico del microscopio (fig. 1).

Fig. 1: Digitalización
de múltiples planos de enfoque de una preparación histológica.
Las soluciones que permiten digitalizar múltiples planos, al menos en una zona de la preparación son: Aperio ScanScope T3 y CS (Remote Revisit), LifeSpan Alias y Nikon Coolscope con ElicpseNet VS. Usando este último sistema, en nuestras pruebas, digitalizamos a 40x un área de 1,494 imágenes, 3 planos (separados 1,5 µm), obteniendo una imagen final de 58.895 x 26.646 píxeles, con un tiempo de escaneado de 3h 27 m y un tiempo adicional de composición de 30 minutos, resultando un fichero de 798 MB.
En otros casos, sin disponer de múltiples planos, es posible obtener una imagen perfectamente enfocada, aun en preparaciones difíciles, gracias al enfoque óptimo de cada punto (Extended focal imaging, EFI, en Olympus SIS .slide). Syncroschopy Synchroscan incorpora un método similar de plano enfocado.
5) -Método de escaneado y ensamblaje de la preparación completa
El primer paso del proceso de digitalización de la preparación
es decidir si se escaneará la preparación completa, una o varias zonas
seleccionadas manualmente o se seleccionarán automáticamente sólo las áreas
con tejido o células. Para estas últimas opciones, que son las más
frecuentemente utilizadas, es necesaria una previsualización previa que
permita detectar, manual o automáticamente (opción disponible en casi todos
los sistemas) dónde hay tejido, lo que evita escanear áreas vacías. Esto se
consigue fotografiando la preparación con una cámara digital de baja
resolución o webcam (Aperio ScanScope, Zeiss Mirax Scan), o digitalizando toda
la superficie con el menor objetivo posible (2x en Olympus SIS .Slide; 1,25x o
2,5x en LifeSpan Alias; 1,25x en Bacus BLISS). Hamamatsu C9600 NanoZoomer
utiliza una cámara adicional de alta resolución (1344x1024 Interline CCD) para
crear el mapa de la preparación. Es un proceso rápido, que en algunos casos
(Zeiss Mirax Scan, Olympus SIS .slide) no supera los 15 segundos.
En algunos casos, es posible seleccionar manualmente más de una zona de
interés (Olympus SIS .slide) o dibujar la forma que tendrá el área que debe
ser escaneada (Nikon EclipseNet VS).
El segundo paso es el ajuste de los puntos de enfoque (mapa de foco) para el área seleccionada (véase calidad del enfoque).
La tercera fase del proceso es el escaneado. Este
proceso de digitalización consiste en ir capturando campos de la preparación
original y posteriormente unir esos fragmentos (de forma real en un solo
fichero, o de forma ficticia en la pantalla del ordenador) para crear la
preparación virtual.
En la práctica totalidad de las soluciones examinadas, todo este proceso puede
ser ajustado manualmente, o se realiza un proceso automático, sin intervención
del usuario, donde el sistema ajusta las mejores opciones para cada
preparación.
La captura de campos microscópicos suele ser cuadro a cuadro, desde la esquina
superior izquierda hasta el borde inferior de la preparación (fig. 2A). En
este método la imagen final es un mosaico constituido por los múltiples
ficheros creados, Sin embargo, otros (Aperio ScanScope) utilizan cámaras
lineales que en vez de capturar un único campo, son capaces de generar tiras
digitalizadas cuya longitud corresponde al ancho de la preparación (fig. 2B).
En los sistemas de cuadrícula, el número de fotogramas capturados es muy
elevado, calculándose que para un área de 15 x 10 mm, a 40x, el número
necesario es de 1.253 con Olympus SIS .slide.
En el caso de utilizar cámaras monocromáticas (LifeSpan Alias, Applied Imaging
Ariol) es necesario realizar 3 capturas (R, G, B) para cada área. En Alias,
con un tamaño CCD de 2.048 x 2.048 píxeles, cada captura será de 4 MB, por lo
que el tamaño de un único fotograma alcanza los 12 MB.
Aperio ScanScope, que utiliza un método de escaneado lineal, ajusta el foco
desde una línea de escaneado hasta la siguiente, con una frecuencia muy
elevada. Además, los defensores del método lineal de escaneado afirman que la
línea siempre es escaneada en el eje óptico de la lente del objetivo, lo que
evita las aberraciones ópticas bidimensionales (simetría circular). Cada una
de las tiras de imagen escaneada con Aperio ScanScope, sin comprimir, es de
200 Mpíxeles con el objetivo 20x.
El proceso de ensamblaje de cada trozo de la preparación con el trozo
adyacente puede hacerse dedos formas distintas:
Ajuste mecánico: Alinear los bordes (tiling) de cada trozo. Es el método utilizado por casi todos los fabricantes.
Ajuste por software: Tomar imágenes adyacentes con una ligera superposición entre sus bordes (stitching), y posteriormente ajustar las imágenes mediante software que hace encajar perfectamente las zonas comunes. Es el método empleado por Aperio ScanScope y LifeSpan Alias.
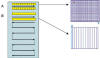
Fig. 2: A.
Escaneado basado en captura secuencial de campos microscópicos individuales
(cuadrícula), en el que cada campo genera un fichero de imagen. B. Escaneado
lineal, en el que los campos de la misma línea se agrupan en un único fichero.
Formatos de ficheros
El resultado final que compone físicamente una preparación digital puede ser:
Múltiples ficheros (a menudo JPEG) en una o varias carpetas. A menudo, se asigna una carpeta para cada aumento (SlidePath, Bacus Bliss). También es posible generar ficheros mapas de bis, sin comprimir (LifeSpan Alias), especialmente útiles para análisis de imagen (4).
Varios ficheros con una o múltiples resoluciones (a menudo JPEG). Es el método empleado por Zeiss Mirax Scan y por el visor Zoomifyer (5).
Un único fichero comprimido (JPEG2000, JPEG).
Un único fichero multirresolución. Toda la información, incluidas la imagen panorámica o thumbnail y las capturas a diferentes resoluciones, se almacena en un único fichero. La estructura de estos ficheros a menudo es piramidal (6) y pueden ser TIFF (Aperio ScanScope), JPEG2000, Flashpix (MicroBrightField Virtual Slice), u otra (VSI en Olympus SIS .slide).
En la Tabla VI se resumen las técnicas de compresión y los formatos de ficheros que utilizan los distintos fabricantes. Con el fin de facilitar su envío a través de las redes de comunicaciones, las imágenes de alta resolución se almacenan troceadas en pequeños fragmentos (de 240 x 240 píxeles en Aperio ScanScope T2 y T3).
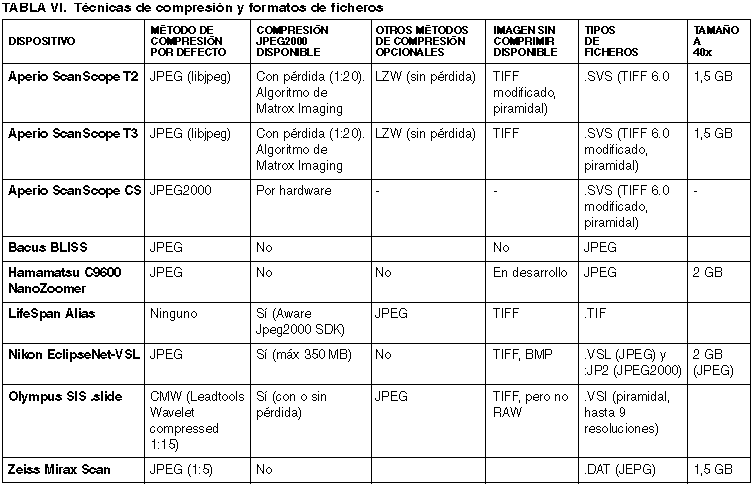
La imagen panorámica de toda la preparación (thumbnail), en Aperio Scanscope, tiene un tamaño de 1024 x 768 píxeles. Otras soluciones permiten ajustar el tamaño de esta imagen en miniatura (LifeSpan Alias, Olympus SIS .Slide).
Cuando se exportan imágenes para publicaciones científicas, presentaciones a congresos, etc., los ficheros obtenidos son también de gran calidad. Por ejemplo, usando el visor ImageScope de Aperio se obtienen imágenes de 1.676 x 926 píxeles (96 ppp).
VISUALIZACIÓN Y PROCESADO DE PREPARACIONES DIGITALES
Cuando el patólogo visualiza una preparación virtual a través del visor correspondiente, necesita realizar los mismos movimientos que realiza con un microscopio:
Desplazarse en los ejes X e Y (desplazamientos laterales y verticales en la pantalla).
Cambiar el aumento o zoom.
Desplazarse por el eje Z (enfocar o cambiar el plano de foco).
Otras funcionalidades.
Desplazarse por los ejes horizontal y vertical
Uno de los principales problemas de los sistemas de microscopía digital es la lentitud en los desplazamientos horizontal y vertical pues el ordenador ha de cargar y descargar continuamente una gran cantidad de información. Como consecuencia, al desplazarse por una preparación virtual es frecuente apreciar cómo los trozos de cada región de la preparación van cargándose en la pantalla. Este es un efecto muy molesto para el patólogo, que está acostumbrado a desplazarse por la preparación rápidamente y la única espera que realiza es la acomodación de sus propios ojos al nuevo campo seleccionado. Para evitar este problema, las soluciones propuestas son trocear la imagen en fragmentos muy pequeños, según el aumento solicitado, y disponer de un buffer en el visor que vaya recogiendo (prefetching) las zonas adyacentes a la visualizada.
En todos los casos, los visores de microscopía virtual deben incorporar una imagen que sirva de mapa de la preparación (thumbnail) que permite saber en todo momento en qué parte de la preparación estamos situados (fig. 3).
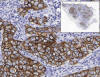
Fig. 3: El
mapa de la preparación (esquina superior izquierda) permite saber dónde está
localizada la zona que estamos examinando a mayor aumento.
Dispositivo de desplazamiento
Para el desplazamiento a través de una preparación, el ratón no es un dispositivo cómodo para el patólogo, acostumbrado a utilizar un mecanismo de ruedas para controlar el desplazamiento fino y el enfoque. Por ello, es posible que en el futuro próximo tengan más éxito para microscopía digital dispositivos como el controlador SmartMove diseñado por Leica Microsystems (fig. 4).

Fig. 4: Controlador
SmartMove de Leica Microsystems.
Cambio de aumento (zoom)
Los visores de preparaciones virtuales permiten al patólogo trabajar de forma similar a como lo hace en el microscopio, utilizando aumentos convencionales (4x, 10x, 20x y 40x). Pero la mayoría de los visores tienen herramientas adicionales que facilitan mucho más el trabajo rutinario, como son:
Una barra de desplazamiento continuo que permite ajustar el aumento necesario de forma más flexible.
Un zoom digital para visualizar rápidamente a mayor aumento sólo pequeñas zonas.
Abrir dos ventanas de la misma preparación con diferentes aumentos.
Desplazamiento por el eje Z (planos de foco)
Las preparaciones histológicas y sobre todo las citológicas pueden precisar la adquisición de múltiples planos de foco, en el eje Z para conseguir una imagen totalmente enfocada en todos los planos. Esto es especialmente interesante, por ejemplo, para apreciar estructuras papilares en frotis citológicos.
En general, la digitalización de múltiples planos en el eje Z suele estar disponible en las soluciones basadas en microscopios robotizados y es más raro encontrarlo en los sistemas basados en escáneres.
Aperio ScanScope T3 y CS disponen del modo «Remote Revisit» que consiste en capturar una serie de planos z («z-stack») de regiones de interés de una preparación digital. De esta forma, en ciertas zonas de la preparación es posible disponer de una serie de imágenes tomadas en diferentes distancias en el eje Z. Esto permite enfocar en tiempo real algunas áreas de la preparación. Ese conjunto de imágenes apiladas del eje Z se almacenan en el servidor junto con la imagen 2D de alta resolución y, durante la visualización, se superpone encima de la misma.
Otras funcionalidades
Una herramienta especialmente útil es el desplazamiento simultáneo y sincronizado de múltiples ventanas ventajas abiertas que permite que el recorrido que realicemos en una ventana se efectúe también en el resto de ventanas abiertas. Esta utilidad facilita la comparación de diferentes cortes realizados del mismo bloque, aunque esos cortes hayan sido rotados o desplazados. Esta opción está disponible en muchas de las soluciones analizadas, como todos los modelos de Aperio ScanScope (Aperio SmartSync™), Zeiss Mirax Scan, o Olympus SIS .slide.
Traza de áreas visitadas: Algunos visores (Zeiss Mirax Scan) permiten comprobar qué zonas de la preparación han sido examinadas.
Anotaciones digitales: Es posible incluir marcas en las preparaciones digitales que permitan volver al mismo sitio cuando volvamos a revisar el caso. Estas anotaciones pueden ser en modo texto o en formato de gráficos (flechas, círculos, etc.). De forma ideal, el sistema debe identifica al autor que hizo cada anotación y al revisar la lista de anotaciones, un clic sobre cada una de ellas presentará la imagen de la zona y el aumento correspondientes. Algunos de los fabricantes que incluyen anotaciones son Aperio ScanScope, Zeiss Mirax Scan y Olympus SIS .slide.
Teleconsulta y Multiconferencia: Las preparaciones virtuales pueden ser visualizadas y discutidas simultáneamente por múltiples patólogos. Este «multicabezal virtual» permite que todos los usuarios vean la misma región, cuando uno de los patólogos toma el control o que alguno de los patólogos se desplace por otras zonas de la misma preparación. Una ventana de diálogos permite discutir sobre los hallazgos de cada uno de los usuarios.
La visión de los campos está sincronizada y todos los usuarios pueden ver los mismos campos a la vez, para lo cual los programas de conferencia incluyen un control de sesiones, para determinar el papel de cada usuario.
Estos sistemas de conferencia remota están disponibles en Aperio ScanScope, Bacus BLISS, Zeiss Mirax Scan y Olympus SIS .slide, entre otros.
Estas herramientas facilitan la utilización de preparaciones virtuales en los programas multicéntricos de garantía de calidad (7).
Además de los módulos específicos para TMAs, descritos más adelante, algunas soluciones de digitalización disponen de módulos que permiten realizar determinados análisis cuantitativos de determinadas zonas de interés dentro de una muestra de la imagen digital. (8). También es posible realizar el análisis de imagen con otros programas compatibles (Olympus AnalySIS). No obstante en su mayoría lo que ofrecen todos estos sistemas son herramientas para realizar tareas de edición, visualización y gestión de imagen.
Reconstrucción tridimensional: Uno de los módulos incluidos en Zeiss Mirax Scan permite realizar reconstrucciones tridimensionales de las preparaciones virtuales.
Software para TMAs: Las preparaciones de matrices de tejidos (TMA) requieren una gestión específica de la información que contienen, para lo cual algunos fabricantes han incorporado módulos específicos para TMAs, como Aperio TMALab™ o módulo TMA para Olympus SIS .slide.
Opciones de exportación: El módulo de visualización de imágenes digitales debe permitir manipularlas (rotaciones, cambios de tamaño, modificar brillo u otros filtros), y sobre todo poder exportarlas a formatos estándares (como JPEG, TIFF sin compresión o simplemente RAW). Por ejemplo, seleccionando una zona que se desee utilizar como imagen fija para insertar en informes anatomopatológicos, publicar artículos, preparar conferencias o enviar por correo electrónico. Las imágenes exportadas pueden incluir las anotaciones realizadas.
En Olympus SIS .slide la imagen puede ser exportada a un formato web estándar (múltiples JPEG cada uno de 512 x 512 píxeles, que pueden ser leídos por Zoomifyer). Además, cuando está destinada a ser utilizada en conferencias a través de Internet, se crea un formato de imagen optimizada (con fragmentos más pequeños).
SISTEMAS DISPONIBLES EN EL MERCADO
Bacus Bliss
Bacus BLISS es una solución pionera en la creación de preparaciones virtuales. En España, Bacus Bliss es distribuido por c.e. Durviz, s.l, con sede en el Parque Tecnológico de Valencia, C/, Leonardo Da Vinci, 10, 46980 Paterna-Valencia. Teléfono 961366107. Fax 961366168. E-mail: durviz@durviz.com. Página web: http://www.durviz.com/
La galería de imágenes en la web está disponible en: http://66.106.109.242/blipathology/index.html (requiere instalar Java).
LifeSpan Biosciences Alias

http://www.lsbio.com/products/automatedimagecapture/
La característica principal de LifeSpan Alias es la calidad de las imágenes obtenidas, gracias a las numerosas modificaciones del microscopio y óptica Leica que sirven de base. Así, el sistema incluye un sistema de iluminación basada en LED, que sucesivamente emite en los tres colores base (RGB). La dirección de contacto es: LifeSpan Biosciences Inc. 2401 4th Avenue Suite 900. Seattle WA 98121 EEUU. Teléfono: 206-374-1175. Fax: 206-464-1723. E-mail: Rajesh.Krishnan@LifeSpanBiosciences.com. Página web: http://www.lsbio.com/
Olympus-Soft Imaging System .slide
http://www.soft-imaging.net/rd/english/3412.htm
Este sistema es de muy fácil uso y la calidad de las preparaciones digitalizadas es muy buena.
Desde 2004, Soft Imaging System (SIS) forma parte de Olympus Europa. La dirección de contacto es: Olympus Optical España, S.A. Vía Augusta, 158
08006 Barcelona. Tel. 93 241 46 63. Fax 93 200 95 80.
Monica.Martinez@olympus.es
http://www.olympus.es
Existe una galería de preparaciones digitales escaneadas con SIS .slide en:
http://www.dotslide.soft-imaging.de/
Nikon Eclipse E600FN con EclipseNet-VSL
http://www.nikon-instruments.com/uk/products/imaging.html y http://www.lim.cz/index.php?lang=en&inc=enet_vsl
Esta solución es la propuesta de Nikon para digitalización completa de preparaciones. Los ficheros de las preparaciones digitales se almacenan en base de datos de la estación de trabajo o en cualquier otro ordenador conectado en red. Todo este proceso puede ser automatizado por el programa EclipseNET. La base de datos permite consultar las preparaciones a través de la red local o a través de Internet, gracias al programa Web DB. El visor correspondiente permite navegar fácilmente por la preparación o realizar anotaciones. Es posible que esta solución pronto se integre en el software Nikon Imaging Software (NIS) y se actualicen los componentes que han dejado de fabricarse.
Nikon Coolscope con EclipseNet-VSL (Europa)

http://www.coolscope.com/ y http://www.eclipsenet.info/
El microscopio digital Nikon Coolscope es una unidad compacta que incluye las funcionalidades de un microscopio óptico y un ordenador, permitiendo transmitir preparaciones a través de la red de comunicaciones mediante protocolos estándar (http y ftp). En Estados Unidos, se distribuye con software de Bacus (Coolscope VS™). La dirección de contacto es: IZASA S.A. C/ Aragón 90. 0815 Barcelona. Tel: +34-(0)902 -20 30 80. Fax: +34-(0)902 -20 30 81. E-mail: dac2@izasa.es Sitio web: http://www.izasa.es/
La galería de preparaciones digitales de LUCIA Net VSL está disponible en: http://www.lim.cz/webdb/index.php?dsn=SampleDatabase&dbid=27&jmeno=guest&heslo=
O en: http://www.lim.cz/index.php?lang=en&inc=webdb (Sample databases)
Carl Zeiss Mirax Scan

Mirax Scan está basado en Hi-Scope (http://www.3dhistech.com/), desarrollado en Hungría por el Dr. Bela Molnar, de la Universidad Semmelweis de Budapest. En España, la distribución y soporte de Mirax Scan la lleva a cabo Grupo Taper, con domicilio en Avda. de la Industria, 49, ed. Fresno, 2.ª planta. 28108 Alcobendas. Madrid. Teléfono: 91 659 65 20, Fax: 91 661 00 84. E-mail: información@grupotaper.com. Página web: http:// www.grupotaper.com
Existen algunos ejemplos disponibles en la web de 3D Histech: http://www.3dhistech.com/viewer2/
Aperio ScanScope T2, T3 y CS


http://wwww.aperio.com/ y http://www.scanscope.com/
La empresa Aperio fabrica tres modelos distintos del escáner de preparaciones ScanScope: T2, T3 y CS.
En España, la distribución y soporte de productos Aperio la realiza Nucliber SA. C/: Hierro, 9. 28045 Madrid. Teléfono: 915 062 940. Fax: 915 394 330. Email: info@nucliber.com Sitio web: http://www.nucliber.com
La galería de imágenes está disponible en: http://images2.aperio.com/ y en: http://images.scanscope.com/
También existen otros ejemplos en las webs del Centro de Medicina Comparada de la Universidad de California en Davis ( http://ccm.ucdavis.edu/imagearchive/) y de la Universidad de Leeds (http://www.virtualpathology.leeds.ac.uk/).
Hamamatsu C9600 NanoZoomer Digital Pathology
http://jp.hamamatsu.com/products/node.do?dir=/application/medical/pa195&lang=en&ext=html
Sistema rápido para escaneo de múltiples preparaciones.
En España, la dirección de contacto es: Hamamatsu Photonics. Parque Tecnologico del Valles. 08290 Cerdanyola. Tel. 93 582 44 30. Fax 93 582 44 31 dcastrillo@hamamatsu.com
Dmetrix DX-40

Este pionero dispositivo desarrollado en Tucson, Arizona, EE.UU., se define como «array microscope», es decir, una matriz de 80 lentes u objetivos en miniatura combinados en un mismo escáner, que permiten capturar en un solo paso toda la preparación (9,10). La dirección de contacto es: DMetrix, Inc. 1141 West Grant Road, Suite 100. Tucson, AZ 85705. EE.UU.
Apollo Telemedicine
http://www.apollotelemedicine.com/
El software de esta empresa se utiliza en las soluciones de MicroBrightField y DMetrix.
Algunos de sus productos son ASAP Imaging®, para compartir preparaciones virtuales y trabajar de forma remota con la misma preparación, facilitan la consulta o segunda opinión; Apollo LIVE™ para videoconferencia; y PathPACS® para la gestión de almacenamiento y recuperación de preparaciones virtuales.
Hay una galería de imágenes disponible en: http://216.204.84.52/
Aurora mScope
Aurora MSC es una empresa especializada en software para la gestión de imágenes en Anatomía Patológica. Sus productos permiten gestionar diversas marcas de escáneres de preparaciones microscópicas (Aperio, Trestle, Nikon,…).
Algunos de los módulos disponibles son: Scanner Interface Manager (creación de imágenes, conversión, distribución, gestión de listas de trabajo, avisos, …), Distributed Digital Slide Server (servidor de imágenes optimizado para preparaciones digitales, que utiliza compresión wavelet con o sin pérdida, un 25% más eficiente que JPEG), Laboratory Image Workflow Manager (seguimiento de las imágenes desde su creación, almacenamiento o integración en el flujo de trabajo de la organización), Authoring and Publishing Server (herramientas para educación en patología).
La dirección de su sede central es: Aurora MSC. 505 University Ave, Suite 1603. Toronto, Canadá. http://www.mscope.net. En España, la dirección de contacto es: rcunado@mscope.net.
Fairfield PathSight
http://www.fairfield-imaging.co.uk/
PathSight es una solución flexible que puede ser utilizada como sistema semi-automático o totalmente robotizado. El visualizador básico java es gratuito.
Fairfield es una empresa británica fundada en 1989 con sede en Nottingham, Inglaterra, y desde 1995 pertenece al grupo Medical Solutions. E-mail: info@medical-solutions.co.uk
Existe una galería de imágenes en: http://www.fairfield-imaging.co.uk/fairfield/mikewells/ y http://interpath1.uio.no/telemedisin/
MicroBrightField Virtual Slice System

http://www.microbrightfield.com/products/virtualslice/whitepaper.html
Virtual Slice System es un módulo software que puede ser acoplado a las soluciones de microscopía de este fabricante, como Neurolucida© o Stereo Investigator©.
La dirección de contacto para Europa es: MicroBrightField Europe, E.K. Matthissonstrasse 6. D-39108 Magdeburg. Alemania. Teléfono: +49 391 732 6989. Fax: +49 391 732 6989. E-mail: rbraul@online.de.
En la web Neuroinformática (http://neuroinformatica.com/), existen algunos ejemplos de preparaciones.
Virtual Slidebox (http://www.path.uiowa.edu/virtualslidebox/).
Samba Naviqap
http://www.sambatechnologies.com/ProduitsUS1.htm
Samba utiliza la estación de microscopía automatizada AcCell, con PC de control y puede combinarse con un servidor de preparaciones digitales (PDB2000).
La dirección de contacto es: Samba Technologies. Zirst. 53 chemin du Vieux Chêne, 38240 Meylan. Francia. Teléfono +33 (0)476 04 00 50. Fax : +33 (0)476 04 15 98. E-mail: samba@sambatechnologies.com
Existe un ejemplo de preparación virtual en: http://www.molecular-dx.com/1_investors/3_samba/40_virtualSlideViewer.html
Syncroscopy SyncroScan
http://www.syncroscopy.com/syncroscopy/syncroscanshort.asp
SyncroScan es una solución software de microscopía automatizada, que es posible acoplar a diversos microscopios. En España, este sistema es distribuido por IZASA S.A.
Hay algunos ejemplos de preparaciones digitalizadas en la dirección web: http://www.syncroscopy.com/syncroscopy/microscopy.asp
Trestle Medmicroscopy y Xcellerator
http://www.trestlecorp.com/medmicro_sysdiagram.asp y http://www.trestlecorp.com/Xcellerator.asp
El programa informático Trestle MedMicroscopy se utiliza en combinación con microscopios robotizados, como Olympus BX-40 u Olympus BX-50 (11). Además, Xcellerator es un conjunto de aplicaciones software para el archivo y gestión de la imagen digital de preparaciones digitales. Puede incorporar herramientas de análisis de imagen como las desarrolladas por la empresa BioImagene (http://www.bioimagene.com)
Tibvn ICS WF

http://www.tribvn.com/tribvn/med/stations.htm
La empresa francesa Tribvn ha desarrollado un módulo para la creación de preparaciones digitales, utilizable en su plataforma de telepatología TeleSlide. Las soluciones de este fabricante de software pueden ser utilizadas con diversos dispositivos, ya sean microscopios robotizados o escáneres de preparaciones.
La dirección de contacto es: Tribvn. 39, rue Louveau. 92320 Châtillon. Francia. Teléfono: +33 (0) 1 55 58 05 20/Fax : +33 (0) 1 55 58 05 30. E-mail: info@tribvn.com Página web: http://www.tribvn.com/
Applied Imaging Ariol

http://www.aicorp.com/products/02path.htm
Ariol es una solución de análisis de imagen automatizado, desarrollado para cuantificar marcadores inmunohistoquímicos y de FISH. Permite, por tanto, utilizar microscopía óptica convencional o de fluorescencia (12).
En España es distribuido por: Olympus Optical España, S.A.
Clarient ACIS (Chromavision)

http://www.chromavision.com/product/acis1.htm
ACIS es el acrónimo de Automated Cellular Imaging System, desarrollado por Chromavision. ACIS está diseñado para el análisis de imagen en inmunohistoquímica (13). En julio de 2005, Dako firmó con Clarient un acuerdo para la distribución y desarrollo de ACIS. En España, la distribución de este equipo, en el momento de la confección de este artículo, la realizaba ATOM SA. Passeig d’Amunt, 29. 08024 Barcelona. Teléfono 93 2847904. Fax 93 2108255. E-mail: jgraells@atomsa.com Párina web: http://www.atomsa.com/
CyTyc ThinPrep® Imaging System
http://www.cytyc.com/lab/lab_cervical_cancer_thinprepimaging.shtml
Esta solución está diseñada para citologías ginecológicas y permite procesar hasta 300 preparaciones en 24 horas. El dispositivo sólo almacena las coordenadas de las áreas de interés junto con la información de identificación asociada a cada preparación.
CONCLUSIONES
Tras analizar las principales características de los sistemas de digitalización de preparaciones disponibles en Anatomía Patológica, comprobamos que estos permiten obtener en aproximadamente una hora, una preparación totalmente digitalizada de gran calidad. Ésta puede ser utilizada con fines diagnósticos, como archivo digital, o con otros fines (segunda opinión, educación médica, formación médica continuada, garantía de calidad, procesado y análisis de imagen e investigación). La práctica totalidad de los productos analizados disponen de software para análisis de micromatrices de tejidos (TMA)
Las preparaciones digitales permiten un archivo permanente de las preparaciones, evitando los problemas habituales de éstas, como pérdidas, roturas o disminución de la tinción o de la señal de fluorescencia.
Algunos dispositivos incluyen un aviso sobre su utilización sólo con fines de investigación y no para procedimientos diagnósticos, a pesar de incluir en su material publicitario que sus principales aplicaciones son para el ámbito clínico. La FDA toma medidas cuando detecta esta práctica (14).
Una vez superados algunos problemas técnicos (lentitud en escaneado, ancho de banda en redes de comunicaciones, capacidad de almacenamiento, interfaz de usuario, y calidad de enfoque), que pudimos comprobar durante el I Congreso de Preparaciones Virtuales en Internet (http://www.conganat.org), en la práctica diaria, el patólogo podría trabajar directamente con preparaciones digitales. Al principio, los sistemas pueden no ser adecuados para técnicas de polarización (amiloidosis, cristales), pero en el futuro, podrán incorporar o simular todos los filtros necesarios.
Ya es posible incorporar enlaces a la preparación virtual en los informes anatomopatológicos finales. El patólogo puede firmar los informes a la vez que visualiza las imágenes del caso correspondiente, lo que permite una doble comprobación (texto e imagen) del diagnóstico que está firmando.
Por otra parte, el proceso intelectual de interpretación de las imágenes para alcanzar un diagnóstico es uno de los pilares de nuestra especialidad y por lo tanto el informe como las imágenes deben llevar siempre asociados el nombre del anatomopatólogo y el servicio de Patología que realiza el diagnóstico. Por ello, sólo deben estar disponibles para compartir las imágenes de los casos ya firmados y validados por el patólogo.
El proceso automatizado de archivo centralizado de imágenes (PACS) y la integración de las preparaciones virtuales con el sistema de información de Patología permitirán disponer de un mecanismo eficaz de búsquedas de imágenes, ya que cada imagen podrá incorporar una cabecera con datos estándar (DICOM) obtenidos del sistema de información de Patología (número de muestra, nombre de patólogo, diagnóstico, SNOMED, etc.).
Agradecimientos
Agradecemos a los fabricantes y distribuidores de los sistemas mencionados en esta revisión su colaboración en la recogida de información técnica. Este trabajo ha sido realizado gracias a la ayuda a la investigación, proyecto número DPI2004-01346 del MEC y fondos FEDER, y a la beca número EQ04002 de la Consejería de Sanidad de la Junta de Comunidades de Castilla-La Mancha.
BIBLIOGRAFÍA
Ferreira R, Moon B, Humphries J, Sussman A, Saltz J, Miller R, Demarzo A. The Virtual Microscope. Proc AMIA Annu Fall Symp. 1997; 449-53. Disponible en: http://citeseer.ist.psu.edu/ferreira97virtual.html
Afework A, Beynon MD, Bustamante F, Demarzo A, Ferreira R, Miller R, Silberman M, Saltz J, Sussman A, Tsang H. Digital dynamic telepathology - the Virtual Microscope. Proc AMIA Symp. 1998; 912-6. Disponible en: http://citeseer.ist.psu.edu/afework98digital.html
EORTC. Tumor Bank. Actualizado el 20 de abril de 2004. Disponible en: http://www.eortc.be/vtb/tumorbank/
Costello SP, Johnston DJ, Dervan PA, O’ Shea DG. Development and Evaluation of the Virtual Pathology Slide: A New Tool in Telepathology. J Med Internet Res 2003; 5: e11. Disponible en: http://www.jmir.org/2003/2/e11/
Galvez J, Munn RJ, Garbutt AW, Cardiff RD. The development of the MMHCC image archives. Seventh Annual Conference for Advancing Pathology Informatics, Imaging and the Internet. Pittsburgh, PA. 2-4 Octubre 2002. Disponible en: http://apiii.upmc.edu/abstracts/posterarchive/2002/abs_include.cfm?file=galvez.html
García Rojo M, Bueno García G, González García J, Carbajo Vicente M. Preparaciones digitales en los servicios de Anatomía Patológica (I). Aspectos básicos de imagen digital. Rev Esp Patol 2005; 38: 69-77. Disponible en: http://www.pgmacline.es/revpatologia/volumen38/vol38-num2/38-2n02.htm
Patel AA, Gil-Bertson J, Dhir R, Becich MJ. Virtual Quality Assurance Protocol: A Quality Assurance Protocol for Pathology Slides From Multiple Institutes. E-Poster. Advancing Pathology Informatics, Imaging, and the Internet (APIII) 2002. Disponible en: http://apiii.upmc.edu/abstracts/posterarchive/2002/index_poster.html
Olson AH, Eichhorn O, Saligrama K. Algorithmic processing of high resolution virtual slides. Advancing Practice, instruction, and Innovation through Informatics Conference. Pittsburgh, 6-8 octubre 2004. Disponible en: http://blog.aperio.com/2004/10/apiii_algorithm.html
Weinstein RS, Descour MR, Liang C, Barker G, Scott KM, Richter L, et al. An array microscope for ultrarapid virtual slide processing and telepathology. Design, fabrication, and validation study. Hum Pathol 2004; 35: 1303-14. Disponible en: http://dx.doi.org/10.1016/j.humpath.2004.09.002
Weinstein RS. Innovations in medical imaging and virtual microscopy. Hum Pathol. 2005; 36: 317-9.
Hitchcock CL, Hitchcock LE. Three Years of Experience with Routine Use of Telepathology in Assessment of Excisional and Aspirate Biopsies of Breast Lesions. Croat Med J 2005; 46(3): 449-457. Disponible en: http://www.cmj.hr/2005/4603/17_Hitchock.pdf
Habib I. Automated microscope slide analysis in pathology. IVD Technology. Mayo de 2005. Disponible en: http://www.devicelink.com/ivdt/archive/05/05/001.html
Divi RL, Dragan YP, Pitot HC, Poirier MC. Immunohistochemical localization and semi-quantitation of hepatic tamoxifen-DNA adducts in rats exposed orally to tamoxifen. Carcinogenesis 2001; 22:1693-9. Disponible en: http://carcin.oxfordjournals.org/cgi/content/full/22/10/1693
Park R. OIVD sends out first warning letter. IVD Technology July 2003. Disponible en: http://www.devicelink.com/ivdt/archive/03/07/005.html y http://www.fda.gov/foi/warning_letters/g3970d.htm