
Vol. 38, n.º 3, 2005
REVISTA
ESPAÑOLA DE
Vol. 38, n.º 3, 2005 |
ORIGINALES
Carmen Etxezarraga, Francisco J. Bilbao, José I. López
Servicio de Anatomía Patológica. Hospital de Basurto.
Universidad del País Vasco (EHU/UPV). Bilbao.
ilopez@hbas.osakidetza.net
RESUMEN
El adenocarcinoma de próstata es el cáncer más frecuente y la segunda causa de muerte por cáncer en la población masculina en los países desarrollados. El volumen de biopsias de próstata recibido en los laboratorios de Anatomía Patológica de nuestros hospitales ha crecido espectacularmente en la última década. El espectro morfológico de esta neoplasia es muy variado, en ocasiones difícil de reconocer, pudiendo simular lesiones benignas o estructuras histológicas normales. Se revisan las características histológicas de los patrones pseudohiperplásico y pseudoatrófico del adenocarcinoma de próstata, dos variedades que simulan los dos hallazgos más frecuentes en patología prostática: la hiperplasia y la atrofia. El reconocimiento de estos patrones poco frecuentes es especialmente importante en las biopsias transrectales para facilitar el manejo correcto de los pacientes.
Palabras Clave: Adenocarcinoma de próstata, patrón pseudohiperplásico, patrón pseudoatrófico, diagnóstico diferencial, inmunohistoquímica.
SUMMARY
Prostate adenocarcinoma is the leading neoplasm and the second cause of death by cancer in males of developed countries. Over the last decade, the number of prostate biopsies has raised tremendously in the Pathology Labs of our Hospitals. The morphologic spectrum of this neoplasm is varied, sometimes difficult to recognise, mimicking benign lesions or normal structures in the area. This paper reviews the histological features of the so-called pseudohyperplastic and pseudoatrophic patterns of prostate adenocarcinomas; the two subtypes of cancer that more closely mimic the two more frequent benign lesions in the prostate. The recognition of these histological variants in core biopsies is necessary to favour the correct patient management.
Key Words: Prostate adenocarcinoma, pseudohyperplastic pattern, pseudoatrophic pattern, differential diagnosis, immunohistochemistry.
INTRODUCCIÓN
El cáncer de próstata es la neoplasia más frecuente en la población masculina en Estados Unidos y la segunda causa de muerte por cáncer (1). El aumento en la frecuencia es especialmente notorio a partir de la 6.ª década de la vida. El paulatino envejecimiento de la población de las sociedades occidentales ha hecho que esta neoplasia sea, hoy en día, un problema sanitario de primer orden. Otros factores implicados en este espectacular crecimiento son: la mayor concienciación de la población frente a este problema sanitario, la puesta en marcha de medidas de detección precoz en revisiones rutinarias, el advenimiento del PSA y sus fracciones como método rutinario fiable de despistaje, y la accesibilidad y eficacia diagnóstica de la biopsia transrectal. Todo ello ha hecho que el volumen de pacientes sometidos a biopsia transrectal esté creciendo espectacularmente en los últimos años (2).
El cáncer de próstata es con mucha frecuencia asintomático durante largos períodos de tiempo, y su detección depende en gran medida de programas de screening específicos o de su búsqueda intencionada en revisiones rutinarias. Sin embargo, aún siendo como es un cáncer con gran prevalencia en nuestra sociedad, su mortalidad está descendiendo en los últimos años (1).
El cáncer de próstata también puede ser un problema diagnóstico para el patólogo. Los programas de calidad instaurados en los sistemas actuales de salud y la propia presión asistencial hospitalaria, hacen que cada vez en mayor medida a los patólogos se les exijan informes rápidos, completos e inequívocos, en ocasiones con muy escaso material o con el cáncer mínimamente representado en la muestra remitida. Este es un problema común a todas las biopsias pequeñas, tanto endoscópicas como obtenidas por punción con aguja gruesa. En la próstata, a este problema se añade la amplia variabilidad histológica del carcinoma prostático (3), la profusión de lesiones benignas que simulan cáncer (4,5) y, viceversa, los carcinomas que simulan en ocasiones lesiones benignas (6).
Aparte del adenocarcinoma convencional y de otras variantes histológicas más o menos frecuentes, existe un grupo de adenocarcinomas «difíciles» que se caracterizan por simular las dos lesiones benignas que prácticamente nunca faltan en cualquier biopsia de próstata: la hiperplasia y la atrofia. Esta revisión pretende llamar la atención sobre las características histológicas del adenocarcinoma con patrón de crecimiento pseudohiperplásico y pseudoatrófico, dos retos diagnósticos para el patólogo.
MATERIAL Y MÉTODOS
La cifra anual de pacientes sometidos a biopsia transrectal de próstata en el Hospital de Basurto se ha multiplicado por más de cinco en los últimos 8 años (tabla 1, gráfico 1), pasando de 153 casos en 1997 a 883 en 2004, siendo 4187 los pacientes totales estudiados por este método en el intervalo 1997-2004. Las cifras anteriores a 1990 eran mucho menores, en comparación casi anecdóticas.
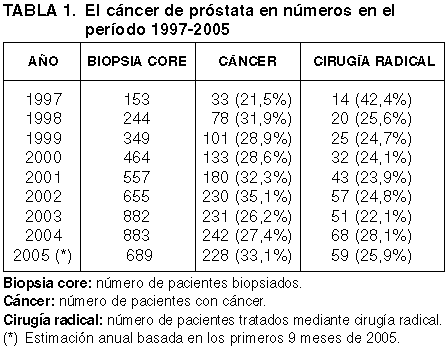
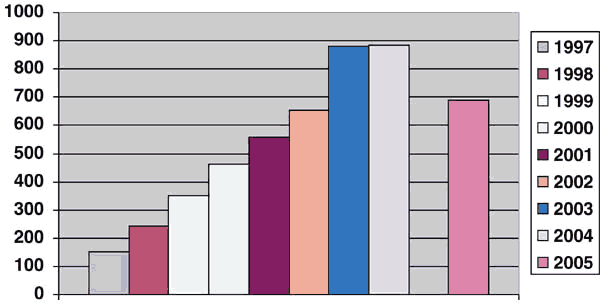
Gráfico 1: Número
total de pacientes biopsiados en el periodo 1997-2004 (incluida la estimación de
2005 basada en el periodo Enero-Septiembre).
Nuestra casuística en este mismo periodo de tiempo dice que en uno de cada tres varones, 1228 en total, el resultado de la biopsia ha sido cáncer (tabla 1, gráfico 2) y de éstos el 25%, 310 pacientes, han sido tratados mediante prostatectomía radical. La utilización de la cirugía frente a otros métodos terapéuticos se ha basado en la decisión de cada paciente y en el protocolo aprobado por el Comité de Tumores Urológicos (7). Tras un fuerte aumento continuado, a partir de 2002 la tendencia es a la estabilización de las cifras, tanto en el número de cánceres diagnosticados como de prostatectomías radicales (tabla 1, gráfico 2).
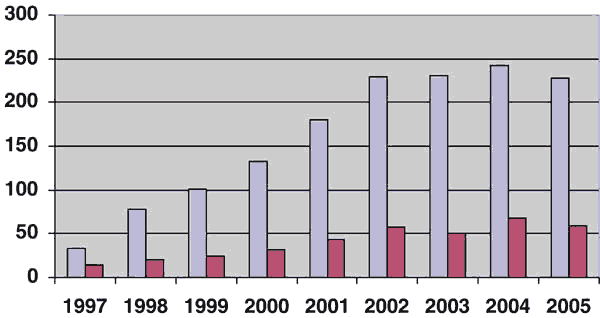
Gráfico 2: Pacientes
con cáncer en la biopsia (azul) y pacientes tratados con prostatectomía radical
(rojo).
CARACTERÍSTICAS HISTOPATOLÓGICAS
Adenocarcinoma con patrón pseudohiperplásico
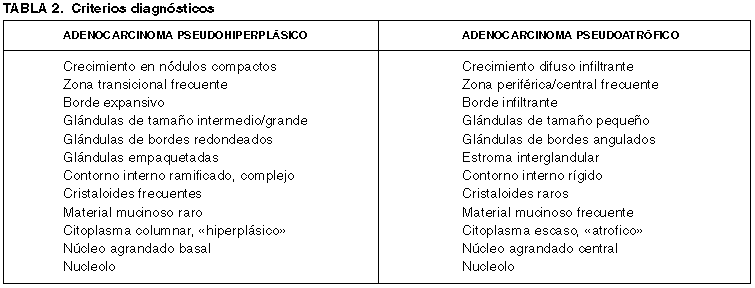
Aproximadamente el 10% de los adenocarcinomas de próstata presentan este patrón de manera más o menos extensa en las prostatectomías radicales (8,9). Sin embargo, solo aparece en el 2% de los adenocarcinomas diagnosticados en biopsias transrectales (9). Presenta un patrón de crecimiento de glándula grande y sus características histológicas más definitorias aparecen esquematizadas en la tabla 2. Cuando el material quirúrgico es abundante no suele plantear problemas diagnósticos, debido tanto a que el muestreo del cáncer en éste material suele ser extenso, como a que con frecuencia se asocia a áreas de morfología convencional que lo delatan al primer vistazo.
Las dificultades mayores aparecen en las biopsias transrectales, en las que el material es escaso y el cáncer puede también estar mínimamente expresado. Para evitar que estos casos pasen desapercibidos, varios autores han llamado la atención sobre este patrón histológico haciendo hincapié en sus características definitorias y en la importancia de su reconocimiento en este material (9-12).
La arquitectura y la citología del patrón pseudohiperplásico se encuentran ilustradas en la figura 1. De manera característica forma nódulos grandes, y tiene un borde de crecimiento típicamente expansivo, comprimiendo el estroma fibromuscular o las glándulas benignas adyacentes. Este dato ya anuncia que, en lugar de encontrar un nódulo completo, en la biopsia veremos sólo una parte de él, bien tangencial incluyendo el borde de expansión, o bien central, mostrando una alta densidad de glándulas. En ambos casos la imagen de pequeño aumento asemeja a la hiperplasia, con proyecciones intraluminales y ramificaciones complejas de sus glándulas. Otro dato que ayuda a confundirlo es el tamaño de las glándulas, que son de medianas a grandes, muy parecidas a las benignas. Puede haber incluso glándulas muy grandes y/o dilatadas quísticamente. El equívoco se completa por fin con el citoplasma de las células neoplásicas, que es amplio, columnar y claro. En el sistema de gradación de Gleason este patrón corresponde al grado 3C (8,10).
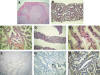
Fig. 1: Adenocarcinoma
Pseudohiperplásico. Hallazgos histológicos e inmunohistoquímicos.
A) Pieza de prostatectomía radical mostrando un gran nódulo neoplásico expansivo
y de bordes netos, pseudohiperplásico, que crece a muy escasa distancia del
borde quirúrgico derecho. B) Cilindro de próstata que presenta una proliferación
de glándulas grandes e irregulares. C) Crecimiento glandular complejo, con
abundantes papilas y ramificaciones. Las células muestran citoplasmas claros y
columnares y núcleos basales agrandados. D) Imagen del patrón pseudohiperplásico
(cilindro central, lado derecho) acompañando a otras zonas de crecimiento
neoplásico convencional. E) Detalle citológico en el que se ven núcleos
agrandados con nucleolos eosinófilos prominentes, disposición celular en hilera
simple, y citoplasmas amplios columnares.F) Pieza de prostatectomía radical
mostrando dos grandes nódulos expansivos neoplásicos que comprimen un área
central benigna. La tinción con CK 5/6 dibuja exclusivamente el contorno basal
del componente benigno. G) Área de adenocarcinoma adyacente a un componente
glandular benigno. La tinción con 34bE12
marca las células basales del componente benigno. H) Positividad citoplásmica
para a-metylacyl
CoA racemasa en las células malignas.
Existen, no obstante, datos que ayudan a identificar a esta lesión como neoplásica. Un hallazgo muy útil es reconocer en vecindad áreas convencionales de adenocarcinoma (9). Este hecho se constata con frecuencia cuando el material estudiado es abundante ya que difícilmente el patrón pseudohiperplásico es el único en todo el volumen del cáncer, pero puede no verse en los cilindros biopsia. Un dato más constante es que el contorno interno de las glándulas suele ser rígido y ramificado, complejo, no ondulante y simple, como en la hiperplasia postatrófica. Sin embargo, el dato más fiable lo proporciona el núcleo, que, como es de esperar, es más grande y contiene generalmente un nucleolo, o a veces más de uno, grande y eosinófilo. Además de los cambios nucleares, los así llamados criterios patognomónicos de cáncer (invasión perineural, glomerulación, fibroplasia mucinosa) (13) resultarán definitivos para el diagnóstico si es que aparecen.
El diagnóstico diferencial específico del adenocarcinoma pseudohiperplásico se plantea con las hiperplasias, convencional, postatrófica (14), con la hiperplasia cribiforme de células claras (15) y con la hiperplasia atípica (16). Otro diagnóstico diferencial interesante se plantea con las glándulas normales de la zona central de la próstata, irregulares y complejas, que dan a veces la impresión de malignidad (17). La figura 2 presenta algunos ejemplos típicos del diagnóstico diferencial de este patrón.

Fig. 2: Detalle arquitectural y
citológico de la hiperplasia, la zona central y la hiperplasia postatrófica.
A) Crecimiento lobulado expansivo
constituido por glándulas de morfología irregular, hallazgo típico de la
hiperplasia convencional. B) Se observa un mantenimiento de la doble hilera
celular en glándulas regulares, redondeadas, con prolongaciones papilares en la
hiperplasia. Los núcleos son basales, pequeños, regulares sin nucleolo y los
citoplasmas columnares, altos, y claros. C) Estroma altamente muscularizado y
glándulas grandes de morfología compleja, típico de la zona central de la
próstata. D) Poliestratificación e hipercromatismo nuclear en las glándulas de
la zona central. En ocasiones se observa pigmentación citoplásmica. E) Glándulas
irregulares en tamaño y contorno, típicas de la hiperplasia postatrófica. F) Las
glándulas en la hiperplasia postatrófica son irregulares y de contornos
ondulados. Las células son de morfología cuboidea, con citoplasmas claros y
núcleos ovalados, verticales y cromáticos. Pueden observarse nucleolos.
Adenocarcinoma con patrón pseudoatrófico
El patrón pseudoatrófico es poco frecuente en el adenocarcinoma de próstata. Egan y cols (18) lo encuentran en el 3% de las prostatectomías radicales y en el 2% de las biopsias transrectales. Se ha puesto en relación con diversas formas de terapia antiandrogénica (19). Presenta un patrón de crecimiento de glándula pequeña y sus características más definitorias están esquematizadas en la tabla 2. Son varios los autores que han llamado la atención sobre este patrón (18-21) y todos ellos han resaltado su parecido con la atrofia acinar, una de las lesiones más frecuentes en patología prostática. Según Cina y Epstein (19), se precisa el 50% o más de glándulas atróficas para etiquetar a un adenocarcinoma de próstata como pseudoatrófico.
La arquitectura y la citología del patrón pseudoatrófico se encuentran ilustradas en la figura 3. En el sistema de gradación de Gleason, este patrón corresponde a un patrón 3B (8). Por regla general crece con bordes infiltrantes y con glándulas pequeñas de contorno angulado, pero también puede remedar la atrofia quística obstructiva. En este caso muestra glándulas dilatadas y redondeadas. En la biopsia transrectal puede coexistir con áreas adyacentes de atrofia, lo cual puede añadir dificultades diagnósticas en la observación a pequeño aumento. Al igual que en el caso anterior, la identificación de áreas vecinas de adenocarcinoma de patrón más convencional ayuda a su reconocimiento, pero esto puede no ocurrir en las biopsias transrectales. De manera característica, suele presentar una pérdida del típico patrón acinar de la atrofia.

Fig. 3: Adenocarcinoma
Pseudoatrófico. Hallazgos histológicos e inmunohistoquímicos.
A) Pieza de prostatectomía radical que presenta
un crecimiento neoplásico con ducto central que mantiene la configuración
arquitectural lobulada de la atrofia. B) Cilindro de próstata que muestra un
foco neoplásico de carácter infiltrante compuesto por glándulas pequeñas. C)
Imagen típica de patrón pseudoatrófico mostrando un crecimiento infiltrante y
microglandular. D) La neoplasia contiene glándulas irregulares compuestas por
células de escaso citoplasma y de contorno angulado creciendo en un estroma
esclerosado. E) Patrón infiltrante microglandular con células de núcleo
agrandado, nucleolo focalmente prominente y citoplasma escaso, de aspecto
atrófico. F) Pieza de prostatectomía radical mostrando una neoplasia
microglandular y ductos dilatados. La tinción con CK 5/6 dibuja el componente
benigno. G) Área de adenocarcinoma adyacente a un componente glandular benigno.
La tinción con 34bE12
marca las células basales del componente benigno. H) Positividad citoplásmica
para a-metylacyl
CoA racemasa en las células malignas.
Los datos más definitorios de este patrón están nuevamente en el núcleo, que es grande y con nucleolo eosinófilo prominente. El citoplasma es escaso, cuboideo o incluso aplanado, y las luces glandulares rígidas, sin plegamientos ni ondulaciones. Puede contener un material basófilo de aspecto mucinoso, lo cual facilita la identificación puesto que no es un hallazgo propio de la atrofia (fig. 4). El estroma interglandular es abundante y suele mostrar cambios de esclerosis.
![]()
Fig. 4: Detalles glandular y
citológico de la atrofia. A)
Crecimiento infiltrante manteniendo la configuración del lóbulo con glándulas
pequeñas de morfología irregular, típico de la atrofia. B) Las glándulas son
pequeñas, irregulares, y de contorno angulado en la atrofia. En ocasiones se
identifica la doble hilera celular. Los núcleos son cromáticos y con nucleolo
pequeño ocasional, y los citoplasmas escasos.
El diagnóstico diferencial se limita básicamente a la atrofia y a la hiperplasia postatrófica. La atrofia mantiene la arquitectura acinar típica, con pequeñas luces glandulares en torno a un ducto central, al menos focalmente mantiene la doble hilera celular, y el núcleo suele ser pequeño y sin nucleolo. Ocasionalmente pueden identificarse pequeños cromocentros, grumos cromatínicos, e incluso pequeños nucleolos pero en nada comparable a los del cáncer. Además, la atrofia suele acompañarse de cierto grado de inflamación. La hiperplasia postatrófica es un hallazgo frecuente en las biopsias transrectales y también puede ser motivo de confusión. Los nucleolos en esta forma de atrofia a veces son evidentes lo cual ayuda a confundir. Sin embargo, el citoplasma cuboideo claro, la disposición vertical de los núcleos dentro del citoplasma, el contorno ondulado de la luz y la irregularidad de forma y tamaño, a veces muy evidente, contrasta con lo mencionado anteriormente para el adenocarcinoma (fig. 2).
CARACTERÍSTICAS INMUNOHISTOQUÍMICAS
La inmunohistoquímica también puede ayudar a la identificación de la naturaleza maligna de estos dos patrones (figs. 1 y 3) (22). En los casos dudosos, la positividad nuclear, continua o discontinua, con p63, o la citoplásmica con queratinas (34bE12, CK 5/6) en la basal confirma el carácter benigno de las glándulas. Algunos autores (23,24) encuentran mayor fiabilidad en la expresión basal de CK 5/6 que en la de CK 34bE12, pero ambas son útiles. Por otra parte, la expresión citoplásmica de a-metylacyl-CoA-racemasa ayuda a identificar las glándulas problema como neoplásicas, pero este anticuerpo muestra una tinción heterogénea, muestra falsos negativos y es poco discriminante cuando se usa solo (25).
CONCLUSIONES
El cáncer de próstata sigue siendo la neoplasia maligna más frecuente en el varón en todos los registros de tumores, y prácticamente la segunda causa de muerte masculina por cáncer. La Sociedad Americana del Cáncer estima que durante 2005 se diagnosticarán algo más de 232.000 nuevos casos, y que aproximadamente 30.000 enfermos morirán por enfermedad metastásica en el mismo periodo (1). Además, un varón de cada 5 desarrollará cáncer de próstata a lo largo de su vida y uno de cada 33 morirá por su causa. El envejecimiento paulatino de la población augura un futuro sombrío a pesar de los esfuerzos terapéuticos que se están llevando a cabo (26).
A pesar de estas cifras, el cáncer de próstata es un problema relativamente reciente para el patólogo. El contacto que tuvieron con esta neoplasia los residentes de Anatomía Patológica de la década de los 80 de nuestro país se limitó casi a la sala de autopsias y a las resecciones transuretrales desobstructivas. Conceptos como PIN, glomerulación, fibroplasia mucinosa, cáncer mínimamente representado, hiperplasia atípica, hiperplasia post-atrófica y otros, tan frecuentes en nuestros días, eran entonces simplemente desconocidos.
El primer acercamiento con intención de ayudar a un tratamiento eficaz y precoz por parte del patólogo al problema clínico generado por el número creciente de casos de cáncer de próstata vino de la mano de la citología. En la década de los 80, se desarrolló en algunos de nuestros centros la citología por punción aspiración transrectal. Esta técnica había sido iniciada años antes con gran éxito por Esposti en el Instituto Karolinska (27), y fue importada poco después a nuestro país por algunos pioneros (28). Aún hoy se practica con buenos resultados, pero su eficiencia se ha visto superada por la de la biopsia.
El cáncer de próstata es un problema sanitario muy frecuente en nuestra sociedad. Debido a su fiabilidad, bajo coste, y facilidad de obtención, la biopsia diagnóstica por vía transrectal se ha convertido en uno de los pilares del screening de esta neoplasia, y por ello su número ha crecido rápidamente en los últimos años en todos los laboratorios de Anatomía Patológica. Sólo las biopsias transrectales de próstata supusieron el 6,1% del total de biopsias recibidas en nuestro Centro tanto en 2003 como en 2004. El conocimiento de la morfología tan variada de este cáncer, así como la de sus simuladores, es necesario para hacer frente al reto de dar información veraz al urólogo para beneficio del enfermo.
BIBLIOGRAFÍA
Jemal A, Murray T, Ward E. y cols. Cancer statistics, 2004. CA Cancer J Clin 2005; 55: 10-30.
Klein EA. What is «insignificant» prostate carcinoma? Cancer 2004; 101: 1923-5.
Varma M, Min WL, Tamboli P, Zarbo RJ, Jimenez RE, Salles PGO, et al. Morphologic criteria for the diagnosis of prostatic carcinoma in leedle biopsy specimens. A study of 250 consecutive cases in a routine surgical pathology practice. Arch Pathol Lab Med 2002; 126: 554-61.
Srigley JR Benign mimickers of prostatic adenocarcinoma. Mod Pathol 2004; 17: 328-48.
Gaudin PB, Reuter VE. Benign mimics of prostatic adenocarcinoma on needle biopsy. Anat Pathol 1997; 2: 111-34.
Jones EC, Young RH. The differential diagnosis of prostatic carcinoma. Its distinction from premalignant and pseudocarcinomatous lesions of the prostate gland. Am J Clin Pathol 1994; 101: 48-64.
López JI, Abad T, Carrandi J, Loizaga A, Martín-Urreta JC, Unda M. La protocolización de la actividad asistencial: cáncer de próstata. Rev Urol 2004; 5: 117-20.
Young RH, Srigley JR, Amin MB, Ulbright TM, Cubilla AL. Tumors of the prostate gland, seminal vesicles, male urethra, and penis. Third Series, Fascicle 28. Washington DC: Armed Forces Institute of Pathology. 2000.
Humphrey PA, Kaleem Z, Swanson PE, Vollmer RT. Pseudohyperplastic prostatic adenocarcinoma. Am J Surg Pathol 1998; 22: 1239-46.
Arista-Nasr J, Cortes E, Pichardo R. Low grade adenocarcinoma simulating benign glandular lesions in leedle prostatic biopsy. Rev Invest Clin 1997; 49: 37-40.
Arista-Nasr J, Martinez Benitez B, Valdes S, Hernández M, Bornstein-Quevedo L. Pseudohyperplastic prostatic adenocarcinoma in transurethral resections of the prostate. Pathol Oncol Res 2003; 9; 232-5.
Levi AW, Epstein JI. Pseudohyperplastic prostatic adenocarcinoma on needle biopsy and simple prostatectomy. Am J Surg Pathol 2000; 24: 1039-46.
Epstein JI. Diagnosis and reporting of limited adenocarcinoma of the prostate on needle biopsy. Mod Pathol 2004; 17: 307-15.
Oppenheimer JR, Wills ML, Epstein JI. Partial atrophy in prostate needle cores: another diagnostic pitfall for the surgical pathologist. Am J Surg Pathol 1998; 22: 440-5.
Ayala AG, Srigley JR, Ro JY, Abdul-Karim FW, Jonson DE. Clear cell cribiform hyperplasia of prostate. Report of 10 cases. Am J Surg Pathol 1986; 10: 665-71.
Bostwick DG, Srigley J, Grignon DJ, Maksem J, Humphrey P, van der Kwast TH, et al. Atypical adenomatous hyperplasia of the prostate: morphologic criteria for its distinction from well-differentiated carcinoma. Hum Pathol 1993; 24: 819-32.
Srodon M, Epstein JI. Central zone histology of the prostate: A mimicker of high-grade prostatic intraepithelial neoplasia. Hum Pathol 2002; 33: 518-23.
Egan AJM, Lopez-Beltran A, Bostwick DG. Prostatic adenocarcinoma with atrophic features: malignancy mimicking a benign process. Am J Surg Pathol 1997; 21: 931-5.
Cina SJ, Epstein JI. Adenocarcinoma of the prostate with atrophic features. Am J Surg Pathol 1997; 21: 289-95.
Kaleem Z, Swanson PE, Vollmer RT, Humphrey PA. Prostatic adenocarcinoma with atrophic features: a study of 202 consecutive completely embedded radical prostatectomy specimens. Am J Clin Pathol 1998; 109: 695-703.
Billis A. Prostatic atrophy: an autopsy study of a histologic mimic of adenocarcinoma. Mod Pathol 1998; 11: 47-54.
Varma M, Jasani B. Diagnostic utility of immunohistochemistry in morphologically difficult prostate cancer: review of current literature. Histopathology 2005; 47: 1-16.
Abrahams NA, Bostwick DG, Ormsby AH, Qian J, Brainard JA. Distinguishing atrophy and high grade prostatic intraepithelial neoplasia from prostatic adenocarcinoma with and without previous adjuvant hormone therapy with the aid of cytokeratin 5/6. Am J Clin Pathol 2003; 120: 368-76.
Abrahams NA, Ormsby AH, Brainard JA. Validation of cytokeratin 5/6 as an effective substitute for keratin 903 in the differentiation of benign from malignant glands in prostate needle biopsies. Histopathology 2002; 41: 35-41.
Farinola MA, Epstein JI. Utility of immunohistochemistry for a-Methylacyl-CoA racemase in distinguishing atrophic prostate cancer from benign atrophy. Hum Pathol 2004; 35: 1272-8.
Pienta KJ, Smith DC. Advances in prostate cancer chemotherapy: A new era begins. CA Cancer J Clin 2005; 55: 300-18.
Esposti PL Cytologic diagnosis of prostatic tumors with the aid of transrectal aspiration biopsy. A critical review of 1110 cases and a report of morphologic and cytochemical studies. Acta Cytol 1966; 10: 182-6.
Cervell Ferrón JM, Cuevas de Aldasoro ML, García Pérez R, Chacón Gómez E, Lescure del Río S, Pérez-Guillermo García M. Aspirative cytology of the prostate: its diagnostic usefulness and effect on care costs. Actas Urol Esp 1989; 13: 28-31.