
Vol. 38, n.º 1, 2005
REVISTA
ESPAÑOLA DE
Vol. 38, n.º 1, 2005 |
ORIGINALES
Morelva Toro1, Antonio Llombart-Bosch
Departamento de Patología, Facultad de Medicina y
Odontología. Universidad de Valencia. España.
1 Doctorando becario de la Universidad de Los Andes. Mérida.
Venezuela.
tmorelva@ula.ve
RESUMEN
Para confirmar la detección inmunohistoquímica de la proteína L1 de HPV de alto riesgo, tanto en citologías con anormalidades en células epiteliales como en biopsias con diagnóstico de carcinoma epidermoide cervical, se seleccionaron aleatoriamente: 11 citologías cervicales del año 2004 con interpretación citológica de anormalidades en células escamosas incluyendo: células escamosas atípicas y lesión intraepitelial escamosa de bajo y alto grado y 50 biopsias de cérvix con carcinoma epidermoide diagnosticados entre los años 1950 y 1980. Todas las muestras, tanto citológicas como histológicas fueron sometidas al procedimiento inmunohistoquímico para la detección de la proteína L1 de HPV de alto riesgo, con anticuerpo de alto riesgo VAHP. El 64% de las muestras citológicas fueron satisfactorias para la evaluación, mientras que 4/11 presentaban inflamación moderada o intensa. El 27% citologías cervicales con cuadro citológico sugestivo de 2 lesión de bajo grado (67%) y 1 lesión de alto grado (33%), mostraron coilocitos con núcleos positivos para L1 de HPV de alto riesgo. Todas las muestras citológicas con atipias fueron negativas para la inmunotinción, así como los 50 casos de carcinoma epidermoide. La detección de la proteína L1 de HPV de alto riesgo en las citologías estudiadas fue baja. Estos resultados sugieren que la inmunodetección de la proteína L1 de HPV de alto riesgo es reducida en las lesiones cervicales severas.
Palabras clave: HPV, proteína L1, cervix uterino, inmunodetección.
SUMMARY
This study was designed to confirm the immunohistochemical detection of the high risk HPV-L1 protein in abnormal epithelial cells observed in cytologies and also in squamous cells carcinomas diagnosed in biopsies. The samples were selected randomly: 11 cervical cytologies of the year 2004 with a cytological interpretation of abnormalities in squamous cells including: atypical squamous cells and in low and high-grade squamous intraepithelial lesions; and 50 cervical biopsies with squamous cells carcinomas diagnosed during the years 1950 and 1980. All the samples, cytological and histological, were subjected to an immunohistochemical procedure in order to detect the high risk HPV-L1 protein, with the antibody VAHP. 64% of the cytological samples were satisfactory for evaluation, while 4/11 presented moderate to intense inflammation. 27% of the cervical cytologies with a suggestive cytologic interpretation of low-grade (67%) and high-grade intraepithelial lesion (33%), showed koilocytes with positive nuclei for the high risk HPV-L1 protein. All the cytologic samples with atipia were negative to the immunostain, as well as the 50 cervical squamous cells carcinomas. The high risk HPV-L1 protein detection in the studied cases was low. These results suggest that the immunodetection of the high risk HPV-L1 protein is reduced in the severe cervical lesions.
Key Words: HPV, L1 protein, uterine cervix, immunodetection.
INTRODUCCIÓN
Las evidencias moleculares y epidemiológicas han solidificado la estrecha relación existente entre la infección persistente por ciertos tipos de Virus Papiloma Humano (HPV) de alto riesgo (AR) oncogénico y el desarrollo y mantenimiento de la enfermedad neoplásica invasiva del cuello uterino (1,2).
La aplicación de las técnicas inmunohistoquímicas en muestras cervicales se iniciaron con la intención de demostrar la presencia de secuencias de ADN- HPV en tejidos malignos y con displasia (3,4).
La búsqueda de una de las proteínas estructurales específicas de la cápside de los HPVs, la proteína L1, se detectó entre el 10% y el 43% de los casos de displasia y fue disminuyendo a medida que la lesión se hacia más severa (5,6).
El papilomavirus infecta las células basales del epitelio escamoso y metaplásico del cuello uterino e inicia su replicación dentro de las células que se van haciendo más maduras y diferenciadas, de forma que una vez y sólo en los estratos superficiales, se expresan las proteínas estructurales tardías L1 y L2, conformando así la partícula viral madura e infectiva (7), hecho que morfológicamente está representado por la displasia coilocítica o lesión intraepitelial de bajo grado (LIEBG), según el sistema Bethesda 2001 (8).
A medida que el proceso neoplásico aumenta en severidad, la transcripción de L1 y L2 tiende a desaparecer, por lo que en las LIE de alto grado y en el cáncer invasivo es poco probable detectar dichas proteínas, aunque en algunos casos de neoplasia invasiva de tipo epidermoide podrían detectarse señales específicas de L1, lo que refleja un alto grado de diferenciación del carcinoma (9). Aunque, Yamagata et al en 1989, detectaron antígeno viral por el método peroxidasa-antiperoxidasa en todos los grados de displasia cervical, indicando que esta podría encontrarse en cualquier grado de lesión cervical.
De igual forma se ha aplicado la inmunotinción para la detección de la proteína L1 de HPVAR en aquellos extendidos celulares del cervix con interpretación citológica compatible con lesiones intraepiteliales escamosas tanto de bajo grado como de alto grado; en estos estudios sólo se logró detectar la proteína L1 en menos del 50% de los casos, siendo significativamente baja (11,12). Sin embargo, en casos de lesiones premalignas de bajo grado que regresan espontáneamente, el porcentaje de detección de L1 fue mayor (69%) según reportan Griesser et al, 2004.
Actualmente, la detección de secuencias genómicas de HPV, tanto en pacientes con citologías que contienen células escamosas atípicas como en LIEBG, se considera un procedimiento adecuado para predecir la aparición de una lesión de mayor significancia clínica (13,14).
Este estudio se ha realizado con el objetivo de confirmar con nuestra propia experiencia y en nuestro medio, la detección inmunohistoquímica de la proteína L1 de HPVAR, tanto en citologías con anormalidades en células epiteliales como en biopsias de tejido con diagnóstico de carcinoma epidermoide de cuello uterino.
MATERIAL Y MÉTODO
Material
Se seleccionaron aleatoriamente: 11 citologías cervicales del año 2004 con interpretación citológica de anormalidades en células escamosas incluyendo: células escamosas atípicas (CEA) y lesión intraepitelial cervical de bajo y alto grado (LIEBG/LIEAG), de acuerdo a los criterios del Sistema Bethesda 2001 (8) y 50 biopsias de cérvix uterino con carcinoma epidermoide diagnosticados entre los años 1950 y 1980 en el departamento de Patología de la Facultad de Medicina y Odontología, Universidad de Valencia. Los casos de carcinoma epidermoide fueron revaluados para confirmar la presencia del tumor y se agruparon de acuerdo al tipo histológico y grado de diferenciación tumoral, siguiendo los criterios histopatológicos estándar (15).
Método
Todas las muestras, tanto citológicas como histológicas, así como el control positivo suministrado por la casa comercial fueron sometidas al mismo procedimiento inmunohistoquímico siguiendo las pautas de la casa comercial; se utilizó el kit de trabajo Viroactiv® HPV High Risk Kit, Wiesbaden, Dinamarca, que incluye los tipos de HPV de alto riesgo 16, 18, 33, 35, 39, 45 y 56 con anticuerpo de alto riesgo VAHP.
A las muestras citológicas previamente teñidas con la técnica de Papanicolaou se les removió el cubreobjeto colocándolas en xilol durante toda la noche; no se fijaron las muestras posteriormente. Se utilizaron cortes en blanco de entre 3 a 5 micras de los casos de biopsia de carcinoma de cuello uterino. Todas las muestras y el control positivo se colocaron en la estufa a 60ºC durante 30 minuto, luego se rehidrataron las muestras en alcoholes de concentraciones decrecientes, 2 minutos en c/uno: 96%, 70%, 50% y finalmente lavamos con agua destilada. Para la recuperación antigénica, se cubrieron las muestras completamente con citrato buffer preparado según indicaciones de la casa comercial y se colocaron en la olla de presión, dejándolas hervir durante 3 minutos.
Para la inmunotinción, cubrimos la muestra con una gota de solución bloqueante a temperatura ambiente durante 5 minutos. Colocamos dos gotas de anticuerpo sobre cada lámina e incubamos en cámara húmeda durante 30 minutos. Lavamos con buffer y agregamos una gota de reactivo de detección a cada frotis e incubamos a temperatura ambiente 30 minutos. Lavamos con buffer y añadimos una gota (50 microlitros) de la solución cromógeno durante 10 minutos. Realizamos la contratinción con hematoxilina. Después de montar en medio acuoso (gelatina glicerinada, MERCK) examinamos al microscopio de luz.
Evaluación de los resultados: el anticuerpo VAHP está dirigido contra la proteína L1 de la cápside de HPV de alto riesgo, que es sintetizada en el citoplasma y entonces transportada al interior del núcleo, por tanto el núcleo de las células infectadas se colorea de rojo. En caso de un nivel elevado de expresión algunas veces se observa también una coloración leve en el citoplasma.
RESULTADOS
Las muestras citológicas del cuello uterino y de tejidos fijados con formalina e incluidos en parafina sometidas a inmunotinción fueron comparadas con el control positivo suministrado por la casa comercial y que fue procesado en las mismas condiciones que a las muestras. La observación de núcleos teñidos de rojo indicaba positividad de la prueba.
Las muestras citológicas incluidas en el estudio fueron evaluadas para determinar la calidad según los criterios del sistema Bethesda 2001; el 64% de estas eran satisfactorias, mientras que el 36% (4/11) presentaban inflamación moderada/intensa como factor de obscurecimiento. Las tres citologías de cuello uterino que resultaron positivas para la proteína L1 eran satisfactorias (fig. 1).
![]()
Fig. 1. Calidad de las muestras citológicas estudiadas de acuerdo con los
criterios del Sistema Bethesda 2001.
Sólo 3/11 (27%) citologías cervicales con cuadro citológico sugestivo de lesión intraepitelial escamosa de bajo grado (2/67%) y de alto grado (1/33%), mostraron núcleos positivos para L1 de papilomavirus de alto riesgo, como se muestra en la tabla 1. Todas las restantes muestras citológicas con atipias fueron negativas. No se observó tinción a nivel citoplasmático, ni en células endocervicales ni en las metaplásicas. Se apreció tinción de fondo (precipitaciones), en algunos leucocitos polimorfonucleares y en algunos bordes celulares.

Los núcleos de los coilocitos presentes en las muestras citológicas se tiñeron de rojo; no se observó coloración ni nuclear ni citoplasmática en el resto de las células presentes, ni en las normales ni en aquellas con atipias leves o marcadas, solamente se observó tinción en los coilocitos (fig. 2).
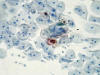
Fig. 2. Caso n.º 7. Citología cervical, lesión intraepitelial escamosa de
bajo grado, se muestra un coilocito con núcleo positivo para la inmunodetección
de L1HPVAR. x200.
En cuanto a los 50 casos de tejido procedentes de carcinomas epidermoides de cuello uterino, incluimos 10 carcinomas epidermoides maduros y bien diferenciados, 10 eran moderadamente diferenciados, 10 inmaduros, 10 inmaduros e indiferenciados y un grupo de misceláneos que incluyó 7 carcinomas anaplásicos y 3 carcinomas microcelulares; todos estos casos resultaron negativos para la detección inmunohistoquímica de la proteína estructural L1 de HPVAR, incluyendo las áreas con atipia coilocitótica asociada (fig. 3).
![]()
Fig. 3. Biopsia de cuello uterino, carcinoma epidermoide bien
diferenciado con áreas de coilocitosis. Nótese que los núcleos son negativos
para la inmunodetección de L1HPVAR. A: en áreas coilocitóticas. B: en áreas de
neoplasia invasiva. x400.
DISCUSIÓN
La detección de secuencias de ADN de papilomavirus humano como E6, E7 y L1 en muestras provenientes del cuello uterino se ha convertido en una herramienta complementaria en el diagnóstico y manejo clínico de las pacientes con lesiones cervicales (16,17).
Los anticuerpos dirigidos contra la proteína estructural mayor de la cápside L1 de los HPVs de alto riesgo (HPVs AR) permitiría la identificación de pacientes portadoras de ésta infección con tipos virales específicos y por ende, mujeres de riesgo a padecer cáncer de cervix uterino (18).
Inicialmente esta proteína L1 (antígeno común específico) altamente conservada entre los virus del género papovaviridae (19), se estudió en muestras de tejido cervical, tanto benignas como displásicas y malignas para así demostrar la asociación del HPV y la carcinogénesis cervical, utilizando técnicas de inmunohistoquímica como la peroxidasa-antiperoxidasa (3,20-23).
En la actualidad también se detecta está proteína L1 de HPVAR, inclusive en frotis cervicovaginales teñidos previamente con Papanicolaou, utilizando secuencias para tipos específicos, procedentes de pacientes con LIEBG y de AG para determinar la posibilidad de progresión a una lesión de grado mayor (11,12).
En este estudio se examinaron los resultados de la inmunotinción para detectar la proteína L1 en citologías cervicales con anomalías y en biopsias con carcinoma epidermoide. Llamó poderosamente la atención el hecho de que todas las muestras histológicas fueron negativas, sin importar el grado de diferenciación tumoral, no mostrando tinción nuclear como se esperaba al menos en las áreas de coilocitosis, ya que en las de neoplasia invasiva, era casi segura la pérdida de la expresión de la proteína L1 debido a la integración del virus al genoma celular; como ocurre en la transformación maligna e inclusive las LIEAG, también pueden resultar negativa a la tinción de L1, debido a las alteraciones que se van sucediendo entre la interacción virus-células según Melsheimer y cols, 2003, quienes utilizando PCR para tipificación viral e inmunohistoquímica para la L1HPV, vieron la prevalencia de L1HPVAR (anticuerpo T16) en 74 pacientes con citología e histología compatibles con LIEBG (44%) y LIEAG (33%), siendo significativamente reducida dicha expresión.
Las muestras citológicas de este estudio se clasificaron previa inmunotinción de acuerdo al estado de adecuación de la muestra para estudio citológico siguiendo los criterios del sistema Bethesda 2001; la visualización y conservación de las características nucleares son claves y necesarias para la correcta evaluación del componente celular (24). La presencia de elementos inflamatorios podrían impedir dicha evaluación y conducir a resultados de falsos negativos (25). El 64% de las citologías cervicales de este estudio fueron satisfactorias, y 4 de ellas (36%) con interpretación citológica de células escamosas atípicas contenían inflamación moderada o intensa como factor de obscurecimiento. Las tres muestras positivas para la proteína L1HPVAR cumplían con los criterios de adecuación.
De las 11 citologías cervicales seleccionadas para este estudio, 3 (27%) mostraron positividad para la prueba de la L1 de HPVAR, de las cuales 2 eran LIEBG (67%) y 1 de LIEAG (33%), las células fueron coilocitos, signo patognomónico de esta infección. Kurman et al en 1983 así como Toki y cols, 1985, encontraron en los tejidos cervicales displásicos la presencia del antígeno viral en el 48% y 18% de las displasias cervicales, respectivamente. Nuestros resultados arrojan un dato porcentual ubicado en este rango, independiente de los tipos de muestras utilizadas entre los estudios. Al igual que en nuestro estudio, estos autores no apreciaron detección de secuencias virales de L1 en las áreas de carcinoma in situ e invasivo indicando además, que las proteínas estructurales del HPV se detectan en epitelios displásicos con cierto grado de diferenciación escamosa.
La reducida detección de la proteína L1 de HPVAR en nuestro estudio pudo tener diversos orígenes; con respecto al kit de trabajo utilizado, este no incluye otros tipos de HPV considerados actualmente de alto riesgo oncogénico (2). También es posible que los HPVs fueran de bajo o intermedio riesgo oncogénico y que tampoco son incluidos en el kit. Esto último también permite pensar en la posibilidad de otras vías de carcinogénesis en nuestro medio geográfico.
Es posible que la antigüedad de nuestras muestras de tejido afectara el resultado debido a una desnaturalización del epitope buscado, impidiendo la adecuada recuperación antigénica, y aunado a esto cabe la posibilidad que la concentración del anticuerpo dirigido contra la proteína L1 fuera baja.
Finalmente, tenemos el hecho de que en los últimos años se han reconocido una serie de variantes de HPVs (Europea, Asiática, Africana1, Africana 2 y Africana-Americana), tanto en carcinomas como en líneas celulares, indicando una diversidad de secuencias dentro de los papilomavirus, específicamente el tipo HPV16, con propiedades biológicas y bioquímicas que afectan la patogenicidad de estos virus (18,26,27).
En conclusión, se detectó la proteína L1 de los HPVAR oncogénico mediante la utilización de Viroactiv® HPV High Risk Kit Wiesbaden, Dinamarca, en un porcentaje reducido de la muestra estudiada, que correspondió al 27% del total de las citologías cervicales con anormalidades en células epiteliales: lesión intraepitelial escamosa de bajo grado (67%) y de alto grado (33%). Las muestras positivas para la proteína L1 cumplían con los criterios de adecuación según el sistema Bethesda 2001; las muestras con células escamosas atípicas fueron negativas al igual que todos los 50 casos de biopsias de cuello uterino con diagnóstico de carcinoma epidermoide incluidas en este estudio. Estos resultados sugieren que la detección de la proteína L1 HPVAR se va reduciendo a medida que las lesiones cervicales se hacen más severas, debido quizás a la integración viral. La proteína L1HPVAR se detecta en las LIEBG, lesiones que aún conservan la propiedad de diferenciación epitelial.
AGRADECIMIENTOS
Este trabajo fue financiado por la Fundación IVO (Valencia).
BIBLIOGRAFÍA
zur Hausen H. Oncogenic DNA viruses. Oncogene 2001; 20:7820-23.
Muñoz N, Bosch X, De Sanjose S, Herrero R, Castellsagué X, Shah K, Snijders P, Meijer CH. Epidemiology classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003; 348: 518-27.
Kurman RJ, Shah KH, Lancaster WD, Jenson AB. Immunoperoxidase localization of papillomavirus antigens in cervical dysplasia and vulvar condylomas. Am J Obstet Gynecol 1981; 140: 931-35.
Kurman RJ, Norris HJ, Wilkinson E, editores. Atlas of tumor pathology. Tumors of the cervix, vagina and vulva. Third Series Fascicle 4. Washington DC: AFIP; 1992. p. 52.
Kurman RJ, Jenson AB, Lancaster WD. Papillomavirus infection of the cervix. II. Relationship to intraepithelial neoplasia based on the presence of specific viral structural proteins. Am J Surg Pathol 1983; 7: 39-52.
Firzlaff JM, Kiviat NB, Beckmann AM, Jenison SA, Galloway DA. Detection of human papillomavirus capsid antigens in various squamous epithelial lesions using antibodies directed against the L1 and L2 open reading frames. Virology 1988; 164: 467-77.
Fernandes SM, Syrjänen KJ. Regulation of cell cycles is of key importance in human papillomavirus (HPV)-asociated cervical carcinogenesis. Sao Paulo Med J 2003; 121: 128-32.
Solomon D, Nayar R, editores. The Bethesda system for reporting cervical cytology. 2.ª ed. New York: Springer Verlag; 2004.
Syrjänen KJ, Syrjänen SM. Molecular biology of papillomaviruses. In: Syrjänen KJ, Syrjänen SM, editores. Papillomavirus infections in human pathology. New York: John Wiley & Sons; 2000. p. 11-51.
Yamagata S, Tsuchida S, Yamamoto K, Kawamura N, Nakamura T, Ueki S, Sugawa T. Human papillomavirus (HPV) antigens and DNA in dysplasia and carcinoma of the uterine cervix. Nippon Sanka Fujinka Gakkai Zasshi 1989; 41: 1334-40.
Melsheimer P, Kaul S, Dobeck S, Bastert G. Immunocytochemical detection of HPV high-risk type L1 capsid proteins in LSIL and HSIL as compared with detection of HPVL1DNA. Act Cytol 2003; 47: 124-28.
Griesser H, Sander H, Hilfrich R, Moser R, Schenck U. Correlation of immunochemical detection of HPVL1 capsid protein in Pap smears with regression of high-risk HPV positive mild/moderate dysplasia. Anal Quant Cytol Histol 2004; 26: 241-45.
Burd E. Human papillomavirus and cervical cancer. Clinical Microbiol Rev 2003; 16: 1-17.
Solomon D. VPH en cribado y triage. Estudio ALTS sobre el triage de ASCUS Y LSIL. www.hpvtoday.com, 2004; 5: 5.
Wright T, Ferenczy A, Kurman RJ. Carcinoma and other tumors of the cervix. En: Kurman RJ, editor. Blaustein’s Pathology of the Female Genital Tract. New York: Spriger-Verlag; 1994, p. 279-326.
Stoler MH. Human papillomavirus biology and cervical neoplasia. Implications for diagnostic criteria and testing. Arch Pathol Lab Med 2003; 127: 935-9.
Wright T, Gatscha RM, Luff R, Prey M. Epitelial Cell Anormalities: Squamous. En: Solomon D, Nayar R, editors. The Bethesda system for reporting cervical cytology. 2.ª ed. New York: Springer; 2004. p. 89-96.
Giannoudis A, Herrington S. Human papillomavirus variants and squamous neoplasia of the cervix. J Pathol 2001; 193: 295-302.
Richart R, Masood S, Syrjänen K, Vassilakos P, et al. Human papillomavirus. IAC Task force summary. Act Cytol 1998; 42: 50-8.
Kurman RJ, Sanz LE, Jenson AB, Perry S, Lancaster WD. Papillomavirus infection of the cervix. I. Correlation of histology with viral structural antigens and DNA sequences. Int J Gynecol Pathol 1982; 1: 17-28.
Toki T, Oikawa N, Tase T, Wada Y, Yajima A, SuzukI M, Higshiiwai H. Immunoperoxidase demostration of papillomavirus antigen in dysplasia of the uterine cervix. Nippon Sanka Fujinka Gakkai Zasshi 1985; 37: 411-15.
Sterrett GF, Alessandri LM, Pixley E, Kulski JK. Assessment of precancerous lesions of the uterine cervix for evidence of human papillomavirus infection: a histological and immunohistochemical study. Pathology 1987; 19: 84-90.
IwasakI T, Sata T, Sugase M, Sato Y , Kurata T, Suzuki K, Ohmoto H, Iwamoto S, Matsukura T. Detection of capside antigen of human papillomavirus (HPV) in bening lesions of female genital tract using anti-HPV monoclonal antibody. J Pathol 1992; 168: 293-300.
Birdsong G, Davey D, Darragh T, Elgert P, Henry M. Specimen adecuacy. En: Solomon D, Nayar R. Editors. The Bethesda system for reporting cervical cytology. 2.ª ed. New York: Springer Verlag; 2004. p. 1-20.
O’Suvillan JP, A’Hern RP, Chapman PA, Jenkins L, Smith R, al-Nafus, A, Brett MT, Herbert A, McKean ME, Waddell CA. A case-control study of true-positive versus false-negative cervical smears in women with cervical intraepithelial neoplasia (CIN) III. Cytopathology 1998; 9: 155-61.
Wheeler CM, Yamada T, Hildesheim A, Jenison SA. Human papillomavirus type 16 sequence variants: identification by E6 and L1 lineage-specific hybridization. J Clin Microbiol 1997; 35: 11-9.
Cruz MR, Cerqueira DM, Cruz WB, Camara G, Brigido MM, Silva EO, Carvalho L, Martins C. Prevalence of human papillomavirus type 16 variants in the Federal District, Central Brazil. Mem. Inst Oswaldo Cruz, Río de Janeiro 2004; 99: 281-82.