
Vol. 36, n.º 4, 2003
REVISTA
ESPAÑOLA DE
Vol. 36, n.º 4, 2003 |
Ihab Abdulkader, José Cameselle-Teijeiro, Jerónimo Forteza
Servicio de Anatomía Patológica, Hospital Clínico Universitario, Santiago de Compostela. iabdulkader@yahoo.com
RESUMEN
El angiomixoma agresivo es una neoplasia poco frecuente que aparece fundamentalmente en la región pélvica y perineal de mujeres durante la edad reproductiva. Se caracteriza por un crecimiento lento y tendencia a la recurrencia local. Presentamos un caso de angiomixoma agresivo localizado en la vulva de una mujer de 44 años. Histológicamente la tumoración es de bordes infiltrativos, hipocelular, mixoide, con numerosos vasos sanguíneos de calibre variable y focos de extravasación hemática. Las células son de apariencia fibroblástica con inmunorreactividad para vimentina, desmina, actina, factor XIIIa y receptores de estrógenos y de progesterona. En el examen ultraestructural se observan células de tipo fibroblástico y miofibroblástico en el seno de un material extracelular pobre en colágeno.
Palabras clave: Angiomixoma agresivo, vulva, inmunohistoquímica, ultraestructura.
SUMMARY
Aggressive angiomyxoma is an uncommon neoplasm that preferentially involves the pelvic and perineal regions of reproductive-age females. Slow growth and propensity for local recurrence characterize these tumors. We report a case of aggressive angiomyxoma of the vulva in a 44-year-old female. Microscopic analysis showed a hypocellular and myxoid tumor with infiltrating margins, numerous large and medium-sized blood vessels, and foci of hemorrhage. The cells have fibroblastic morphology and are immunoreactive for vimentin, desmin, actin, factor XIIIa, and estrogen and progesterone receptors. Electron microscopic examination shows fibroblastic-like and myofibroblastic-like cells into the surrounding finely granular matrix with scattered collagen fibers.
Key Words: Aggressive angiomyxoma, vulva, immunohistochemistry, electron microscopy.
INTRODUCCIÓN
El término angiomixoma agresivo (AA) fue propuesto por Steeper y Rosai en 1983 para definir una neoplasia mesenquimal mixoide de crecimiento lento que aparece fundamentalmente en la región pélvica, genital y/o perineal de mujeres adultas (1). Es un tumor poco frecuente, con unos 126 casos publicados en la literatura (1-18). La relación mujer/hombre es de 6:1, es más frecuente durante la edad reproductiva y muestra un rango de edad de presentación que oscila entre los 11 y 82 años, con un pico de incidencia en la tercera década (2-4). El AA ha sido descrito también en vagina, cavidad uterina, vejiga, retroperitoneo, espacio isquiorrectal, recto y extremidades inferiores. En los varones aparece en el escroto, cordón espermático, epidídimo y región inguinal (parafunicular). Son neoplasias grandes, de 3 a 60 cm de diámetro, sólidas, no encapsuladas y de baja densidad radiológica (1, 4-11). Aunque se consideran neoplasias agresivas localmente, se ha descrito un caso aislado con metástasis pulmonares y mediastínicas (12). El objetivo de este artículo es presentar las características histológicas, inmunohistoquímicas y ultraestructurales de un AA de vulva con énfasis en el diagnóstico diferencial.
DESCRIPCIÓN DEL CASO
Historia clínica
La paciente, una mujer de 44 años, ingresó de urgencia por el sangrado de una masa en el lado izquierdo de vulva, que había crecido en los últimos meses. Como antecedentes personales refiere que hace un año fue tratada (drenaje quirúrgico) por un cuadro de Bartholinitis y la exéresis de un lipoma en el antebrazo izquierdo y de otro lipoma en el cuello. En la exploración se apreció una tumoración blanda y móvil, de 22 cm, que se extiende desde la zona paraclitorídea izquierda hasta el periné y la nalga izquierda. Dado el tamaño de la masa y el riesgo de un nuevo sangrado, se realizó la intervención quirúrgica de forma programada, con resección completa de la masa y un curso clínico postoperatorio sin complicaciones.
Anatomía patológica
La pieza quirúrgica pesaba 384 g, medía 15 x 13 cm y era de superficie externa lisa bien delimitada pero no encapsulada. Al corte era blanda, de coloración blancogrisácea y apariencia mixoide (fig. 1).
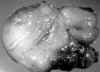
Fig. 1. La sección de corte es
blancogrisácea, homogénea y mixoide.
En el estudio histológico la tumoración presentaba bordes infiltrativos con atrapamiento de tejido adiposo y focalmente de nervios de mediano tamaño. A pequeño aumento la neoplasia es hipocelular y mixoide, con moderado incremento de la celularidad alrededor de las estructuras vasculares (fig. 2). Hay numerosos vasos sanguíneos de calibre variable con engrosamiento hialino de la adventicia y focos de extravasación hemática (fig. 3). Las células tumorales son de apariencia fibroblástica, fusiformes o estrelladas, con ausencia de pleomorfismo y de figuras de mitosis.

Fig. 2. Imagen histológica en la que
se observa infiltración del tejido adiposo peritumoral (x50).
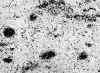
Fig. 3. Características estructuras
vasculares de calibre variable con pared hialinizada y focos de extravasación
hemática (x100).
El estudio inmunohistoquímico resultó positivo para vimentina, desmina, actinas (músculo liso y HHF-35), factor XIIIa y receptores de estrógenos y de progesterona (figs. 4 y 5). El índice de proliferación (MIB-1) fue <2%. La proteína S-100, citoqueratinas (CAM5.2, AE1-AE3), factor VIII, CD31, CD34, bcl-2 y p53 fueron negativos. En el estudio ultraestructural se observaron células de tipo fibroblástico, ricas en retículo endoplásmico, en el seno de un material extracelular pobre en colágeno y rico en mucopolisacáridos. Algunas células tenían también microfilamentos con cuerpos densos que las caracterizaron como miofibroblastos (fig. 6).

Fig. 4. Intensa positividad para
vimentina (A) (x200) y desmina (B) (x200).

Fig. 5. Inmunorreactividad nuclear
para receptores de estrógenos (A) (x200) y progesterona (B) (x200).
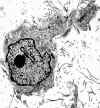
Fig. 6. Célula con diferenciación
miofibrobástica que muestra microfilamentos agrupados en cuerpos densos
(x4000).
DISCUSIÓN
La histogénesis del AA ha sido motivo de controversia. Se ha sugerido un origen neural en base a la presencia de fascículos nerviosos, al estroma mixoide y a la presencia de mastocitos, sin embargo, el estudio inmunohistoquímico para la proteína S-100 es negativo y el examen ultraestructural sólo en muy raras ocasiones ha mostrado imágenes de células de Schwann (5,13). Por otra parte, la inmunonegatividad para el CD31, CD34 y el factor VIII, así como la ausencia de membrana basal prominente y de cuerpos de Weibel-Palade, van en contra de un origen en células endoteliales (5). Tal como se había propuesto en la descripción original (1), los estudios inmunohistoquímicos y ultraestructurales sugieren un origen miofibroblástico (14,15). A diferencia del AA, el angiomiofibroblastoma es una neoplasia bien delimitada, de menor tamaño, con tendencia a la hipercelularidad perivascular, apariencia epitelioide, presencia de células multinucleadas y negatividad para actina. Es probable que el AA se origine a partir de células estromales especializadas del tracto genital inferior (15). Dichas células experimentarían grados variables de diferenciación muscular que explicarían algunos resultados discordantes de la literatura y también el que algunos casos de AA muestren solapamiento con el angiomiofibroblastoma (13). En nuestro caso, la diferenciación mioide es apoyada por el estudio inmunohistoquímico y ultraestructural.
Aunque a nivel molecular los mecanismos patogenéticos no están claros, el AA se asocia con alteraciones del gen HMGIC localizado en el cromosoma 12, al igual que ocurre en otros tumores mesenquimales benignos (19).
El diagnóstico diferencial del AA incluye al mixoma intramuscular y yuxtaarticular, mixoma cutáneo, neurofibroma mixoide, leiomioma mixoide, fibromatosis pélvica, lipoma de células fusiformes, liposarcoma mixoide y mixofibrosarcoma (2,12,16,20). Los mixomas tienen diferente localización, un patrón lobulado y menor celularidad y vascularización con negatividad para desmina. El neurofibroma mixoide es positivo para la proteína S-100, mientras que el lipoma de células fusiformes es negativo para desmina y ambos carecen de la vascularización típica del AA. Aunque el leiomioma mixoide es frecuente en la región pélvica, difiere del AA en el patrón vascular y por la presencia de haces de células de tamaño mayor con citoplasma amplio y eosinófilo. En la fibromatosis pélvica las áreas mixoides coexisten con haces de células fusiformes entremezcladas con abundante colágeno típicos de la fibromatosis y faltan los vasos de mayor calibre y de paredes gruesas característicos del AA. El liposarcoma mixoide es raro en la pelvis y se distingue por su patrón vascular plexiforme y la presencia de lipoblastos. El patrón vascular curvilíneo, la hipercromasia y la atipia celular caracterizan al mixofibrosarcoma y permiten su distinción del AA.
El tratamiento de elección es la resección local amplia (2,5,18). En los casos tratados de forma conservadora se requiere seguimiento a largo plazo ya que la recidiva puede aparecer varios años después de la resección (1,2,20). A pesar de tratarse de tumores de crecimiento lento (2), existe un elevado índice de recurrencias por excisión incompleta debido a la naturaleza infiltrativa de los márgenes de la lesión (2,20). La positividad para receptores de estrógenos y de progesterona se ha relacionado con la aparición de esta neoplasia en las mujeres durante la edad reproductiva y por ello algunos autores proponen la terapia hormonal como una alternativa en aquellos casos en los que la tumoración no pueda ser extirpada en su totalidad (2,19).
AGRADECIMIENTOS
Los autores agradecen a Inés Fernández Campos y Ángel Vázquez Boquete la colaboración técnica.
BIBLIOGRAFÍA
Steeper TA, Rosai J. Aggressive angiomyxoma of the female pelvis and perineum. Am J Surg Pathol 1983; 7: 463-75.
Fetsch JF, Laskin WB, Kindblom LG. Aggressive angiomyxoma: a clinicopathologic study of 29 female patient. Cancer 1996; 78: 79-90.
Matsuzaki A, Morita T, Kobayashi Y, Kumamaru T, Tokue A. Aggressive angiomyxoma in an 11-year old boy. BJU Int 2001; 88: 124.
Madrigal B, Veiga M, Vara A, et al. An aggressive inguinal (parafunicular) angiomyxoma in a male patient. Arch Esp Urol 1999; 52: 785-8.
Bégin LR, Clement PB, Kirk ME, Jothy S, McCaughey WTE, Ferenczy A. Aggressive angiomyxoma of pelvic soft parts: a clinicopathologic study of nine cases. Hum Pathol 1985; 16: 621-8.
Skalova A, Zamecnik M, Michal M, Optarny V. Aggressive angiomyxoma presenting as polyp of uterine cavity. Pathol Res Pract 2000; 196: 719-25.
May F, Luther A, Mohr W, Bachor R, Hautmann RE. Recurrent aggressive angiomyxoma of the urinary bladder. Case report and review of the literature. Urol Int 2000; 65: 57-9.
Rhomberg W, Jasarevic Z, Alton R, Kompastscher P, Beer G, Breitfellner G. Aggressive angiomyxoma: irradiation for recurrent disease. Strahlenther Onkol 2000: 76: 324-6.
De la Ossa M, Castellano-Sanchez A, Alvarez E, Smoak W, Robinson MJ. Sonographic appearance of aggressive angiomyxoma of the scrotum. Clin Ultrasound 2001; 29: 476-8.
Carlinfante G, De Marco L, Mori M, Ferreti S, Crafa P. Aggressive angiomyxoma of the spermatic cord. Two unusual cases occurring in childhood. Pathol Res Pract 2001; 197: 139-44.
Vella R, Calleri D. Superficial angiomyxoma of the epididymis. Presentation of a new case and clinical considerations. Minerva Urol Nefrol 2000; 52: 77-9.
Siassi RM, Papadopoulos T, Matzel KE. Metastasizing aggressive angiomyxoma. N Engl J Med 1999; 341: 1772.
Fletcher CD, Tsang WY, Fisher C, Lee KC, Chan JK. Angiomyofibroblastoma of the vulva. A benign neoplasm distinct from aggressive angiomyxoma. Am J Surg Pathol 1992; 16: 373-82.
Manivel C, Steeper TA, Swanson P. Aggressive angiomyxoma of female pelvis: an immunoperoxidase study [Abstract]. Lab Invest 1987; 56: 46A.
Skálová A, Michal M, Husek K, Leivo I. Aggressive angiomyxoma of the Pelvioperineal Region. Immuno-histological and Ultrastructural Study of Seven Cases. Am J Dermatopathol 1993; 15: 446-51.
Simó M, Zapata C, Esquius J, Domingo J. Aggressive angiomyxoma of the female pelvis and perineum. Report of two cases and review of the literature. Br J Obstet Gynaecol 1992; 99: 925-7.
Chan YM, Hon SW, Ng TY, Wong LC, Chan IM. Aggressive angiomyxoma in females: is radical resection the only option. Acta Obstet Gynecol Scand 2000; 79: 216-20.
López López C, Romero Maroto J, Quilez Fenoll JM, Mayol Belda MJ, Boldo Diaz A. New location of aggressive angiomyxoma: the blader. Actas Urol Esp 1993; 17: 611-3.
Nucci MR, Weremowicz S Neskey DM, Sornberger K, Tallini G, Morton CC, et al. Chromosomal translocation t(8;12) induces aberrant HMGIC expression in aggressive angiomyxoma of the vulva. Genes Chromosomes Cancer 2001; 32: 172-6.
Weiss SW, Goldblum JR. Benign soft tissue tumors and pseudotumors of miscellaneous type. En: Enzinger FM, Weiss SW, editores. Soft Tissue Tumors. 4th ed. St. Louis: Mosby; 2001. p. 1419-81.